
【題目】在如圖所示的物質轉化關系中.A是常見氣態氫化物,B是能使帶火星的木條復燃的無色無味氣體,E的相對分子質量比D大17,G是一種紫紅色金屬單質.(部分反應中生成物沒有全部列出,反應條件未列出) 
請回答下列問題:
(1)B的化學式為 .
(2)A的電子式為 .
(3)反應①的化學方程式為 .
(4)反應②的離子方程式為 .
【答案】
(1)O2
(2)![]()
(3)3NO2+H2O=2HNO3+NO
(4)3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O
【解析】解:B能使帶火星的木條復燃的無色無味氣體,則B是氧氣.G是一種紫紅色金屬單質,則G是銅.A是常見的氣態氫化物,能與氧氣反應生成C與F,C能與氧氣反應生成D,則C為氧化物,F是水,D與水反應得到E,E能與Cu反應得到C,中學中N、S元素化合物符合轉化關系,由于E的相對分子質量比D大17,可推知E為硝酸、D是NO2 , 則A是氨氣,C是NO,(1)由以上分析可知B為O2 , 所以答案是:O2;(2)由上述分析可知,A為NH3 , 電子式為: ![]() ,所以答案是:
,所以答案是: ![]() ;(3)反應①的化學方程式為3NO2+H2O=2HNO3+NO;(4)反應②為銅和稀硝酸的反應,反應的離子方程式為3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O, 所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O.
;(3)反應①的化學方程式為3NO2+H2O=2HNO3+NO;(4)反應②為銅和稀硝酸的反應,反應的離子方程式為3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O, 所以答案是:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O.


科目:高中化學 來源: 題型:
【題目】鹵族元素的單質和化合物很多,我們可以利用所學物質結構與性質的相關知識去認識和理解它們。
(1)鹵族元素位于元素周期表的_________區;溴的價電子排布式為_________;
(2)在一定濃度的溶液中,氫氟酸是以二分子締合(HF)2 形式存在的。使氫氟酸分子締合的作用力是________;
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的結構分別如圖 I、 II 所示:
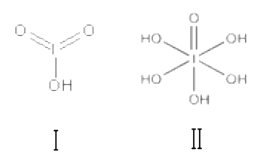
請比較二者酸性強弱: HIO3_____ (填“>”、“<”或“=”)H5IO6;
(4)已知 ClO2- 為 V 形結構,中心氯原子周圍有四對價層電子。ClO2-中心氯原子的雜化軌道類型為___________,寫出一個ClO2-的等電子體_________;
(5)如圖為碘晶體晶胞結構。有關說法中正確的是_____________。
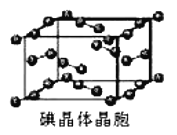
A.碘分子排列有2 種不同取向,2 種取向不同的碘分子以4 配位數交替配位形成層結構
B.用均攤法可知平均每個晶胞中有 4 個碘原子
C.碘晶體為無限延伸的空間結構,是原子晶體
D.碘晶體中存在的相互作用有非極性鍵和范德華力
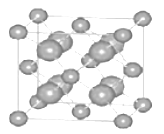
(6)已知 CaF2 晶體(如圖)的密度為 ρg/cm3, NA為阿伏加德羅常數,棱上相鄰的兩個 Ca2+的核間距為 a cm,則CaF2 的相對分子質量可以表示為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的用途說法不正確的是
A. Si 可用于制造光導纖維 B. 鈉、鉀合金可用于原子反應堆作熱交換劑
C. FeCl3 溶液可作為銅質電路板蝕刻劑 D. 漂白粉可用于自來水殺菌消毒
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測血鈣的含量時,進行如下實驗:
①可將2 mL血液用蒸餾水稀釋后,向其中加入足量草酸銨(NH4)2C2O4晶體,反應生成 CaC2O4沉淀,將沉淀用稀硫酸處理得H2C2O4溶液。
②將①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化產物為CO2,還原產物為Mn2+。
③終點時用去20mL l.0×l0-4 mol./L的KMnO4溶液。
(1)寫出用KMn04滴定H2C2O4的離子方程式___________。
(2)判斷滴定終點的方法是____________。
(3)③步驟中取酸性KMnO4溶液溶液時,酸式滴定管用蒸餾水洗過后沒有潤洗,則測得的血鈣質量分數_______(填“偏大”、“偏小”或“無影響”)。
(4)計算:血液中含鈣離子的濃度為_____mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分別通入乙烯加入苯,都能觀察到溴水褪色現象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2兩種同分異構體
C—CH=CH2兩種同分異構體
D. 芳香烴![]() 和
和![]() 的一氯代物都只有2種
的一氯代物都只有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化鈰(CeO2)是一種重要的稀土氧化物,平板電視顯示屏生產過程中產生大量的廢玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物質)。某課題組以此粉末為原料,設計如下工藝流程對資源進行回收,得到純凈的CeO2和硫酸鐵銨晶體。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是___________________。
(2)濾液1中加入H2O2溶液的目的是________________________________。
(3)某同學設計實驗證明濾液1中含有Fe2+,他所用的試劑為________________。
(4)已知溶液中的Fe2+可以和難溶于水的FeO(OH)反應生成Fe3O4,請書寫該反應的離子方程式___________________________________。
(5)由濾液2生成Ce(OH)4的離子方程式_____________________。
(6)硫酸鐵銨晶體[Fe2(SO4)3·2(NH4)2SO4·3H2O]廣泛用于水的凈化處理,請用離子方程式解釋其作用原理:______________________________,相對于去除中性廢水,其在去除酸性廢水中的懸浮物時效率_________(填“增強”或“降低”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25 ℃時,密閉容器中X、Y、Z三種氣體的初始濃度和平衡濃度如下表:
物質 | X | Y | Z |
初始濃度(mol·L-1) | 0.1 | 0.2 | 0 |
平衡濃度(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列說法錯誤的是( )
A. 反應達平衡時,X的轉化率為50%
B. 反應可表示為:X+3Y![]() 2Z,其平衡常數為1 600
2Z,其平衡常數為1 600
C. 改變壓強可以改變此反應的平衡常數
D. 改變溫度可以改變此反應的平衡常數
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com