
【題目】【化學——選修2:化學與技術】聯合生產是實現節能減排的重要措施,工業上合成氨和硝酸的聯合生產具有重要意義。下面是工業上合成氨的簡易流程:


(1)設備A內部結構如右下圖所示,其名稱是________ ,其中發生的化學反應方程式為_________;生產中原料氣必須進行脫硫,目的是____________。選擇500℃進行反應的主要原因是___________;
(2)設備B的名稱是冷凝塔,圖中a和b是兩個通水口,其中入水口是 (填“a”或“b”)。
(3)氮氣和氫氣的混合氣體通過壓縮機壓縮的原因是________________________________。
(4)生產出來的NH3可以用來生產硝酸。其中在氨氣催化氧化過程中,不同溫度下生成產物可能有所不同,溫度對氨氧化產物產率的影響如下圖所示;當溫度大于900℃時,NO的產率下降的主要原因是__________________。

(5)某化肥廠用NH3制備NH4NO3。已知:由NH3制NO的產率是94%,NO制HNO3的產率是89%,則制HNO3所用NH3的質量占總耗NH3質量(不考慮其它損耗)的 %(保留兩位有效數字)。
【答案】(1) (氨)合成塔N2+3H2![]() 2NH3 防止催化劑中毒
2NH3 防止催化劑中毒
此溫度下催化劑效率最高 (2)b (3)增大壓強,加快反應速率,使平衡向生成NH3的方向進行(4)部分NO轉變成N2 (5) 54
【解析】
試題分析:(1)合成氨的工業設備是合成塔,其中發生的化學反應方程式為N2+3H2![]() 2NH3;生產中原料氣必須進行脫硫,目的是防止催化劑中毒;N2與H2合成NH3所用的催化劑是鐵砂網,溫度過低,反應速率較慢,溫度較高,不利合成氨氣,選擇500℃的主原因是在這個溫度下催化劑活性最大;
2NH3;生產中原料氣必須進行脫硫,目的是防止催化劑中毒;N2與H2合成NH3所用的催化劑是鐵砂網,溫度過低,反應速率較慢,溫度較高,不利合成氨氣,選擇500℃的主原因是在這個溫度下催化劑活性最大;
(2)B為冷凝器或冷卻塔,冷卻時逆向冷卻效果好,則入水口應考慮下進上出,即答案為b;
(3)合成氨反應是放熱的體積減小的可逆反應,增大壓強,加快反應速率,平衡向氣體體積減小的方向移動,即平衡朝生成NH3的方向進行;
(4)各反應為放熱反應,高溫下不利于向正反應進行,根據圖像可知,溫度高于900℃時,NO的產率降低,氮氣的產率增大,故溫度高于900℃時應是部分NO轉化為N2;
(5)由NH3制NO的產率是94%、NO制HNO3的產率是89%,根據氮原子守恒可知,NH3~NO~HNO3,則1mol氨氣可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3=NH4NO3,則該反應消耗的氨氣的物質的量為0.8366mol,氨氣的質量之比等于物質的量之比,則制HNO3所用去的NH3的質量占總耗NH3質量的百分數為![]() ×100%=54%;即制HNO3所用去的NH3的質量占總耗NH3質量的54%。
×100%=54%;即制HNO3所用去的NH3的質量占總耗NH3質量的54%。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、W、R是5種短周期元素,其原子序數依次增大。X是周期表中原子半徑最小的元素,Y原子最外層電子數是次外層電子數的3倍,Z、W、R同周期,R與Y同主族,Z、W原子的核外電子數之和與Y、R原子的核外電子數之和相等。下列說法正確的是
A.簡單氫化物的熔沸點:Y<RB.簡單離子半徑:R>Y>Z>W
C.X2Y2和Z2Y2均為含有非極性鍵的離子化合物D.常溫下,W的單質與R的最高價含氧酸的濃溶液不發生反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵又稱聚鐵,化學式為[Fe2(OH)n(SO4)3-0.5n]m,廣泛用于污水處理。實驗室利用硫酸廠燒渣(主要成分為鐵的氧化物及少量FeS、SiO2等)制備聚鐵和綠礬(FeSO4·7H2O),過程如下:

(1)驗證固體W焙燒后產生的氣體含有SO2的方法是:
___________________________________________________________________。
(2)實驗室制備、收集干燥的SO2,所需儀器如下。裝置A產生SO2,按氣流方向連接各儀器接口,順序為a→____→____→____→____→f。
裝置A中發生反應的化學方程式為_________________________________________。
裝置D的作用是_____________,裝置E中NaOH溶液的作用是__________________。

(3)制備綠礬時,向溶液X中加入過量__________,充分反應后,經過濾操作得到溶液Y,再經濃縮、結晶等步驟得到綠礬。過濾所需的玻璃儀器有_______________________。
(4)欲測定溶液Y中Fe2+的濃度,需要用容量瓶配制KMnO4標準溶液,定容時視線應_____________________,直到_____________________。用KMnO4標準溶液滴定時應選用________滴定管(填“酸式”或“堿式”)。
(5)溶液Z的pH影響聚鐵中鐵的質量分數。若溶液Z的pH偏小,將導致聚鐵中鐵的質量分數______(填“偏大”、“偏小”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把0.6 mol X氣體和0.6 mol Y氣體混合于2 L密閉容器中,使它們發生如下反應:2X(g)+Y(g) == nZ(g)+2W(g) 1 min末已生成0.2 mol W ,若測知以Z的濃度變化表示的反應速率為0.005 mol·L-1·s-1 ,計算:
(1)前1 min內用X的濃度變化表示的平均反應速率。
(2)1 min末時Y的濃度。
(3)化學反應方程式中n的值是多少?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.(1)右圖為1molNO2(g)和1molCO(g)反應生成NO(g)和CO2(g)過程中的能量變化示意圖。已知E1=134KJ/mol,E2=368KJ/mol( E1、 E2為反應的活化能)。若在反應體系中加入催化劑,反應速率增大,則E1、△H的變化分別是 、 (填“增大”、“減小”或“不變”)。寫出該 反應的熱化學方程式 。
(2)若反應SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自發進行,則△H___0。
A.大于 B.小于 C.等于 D.大于或小于都可


Ⅱ.以CO2為碳源制取低碳有機物成為國際研究焦點,下面為CO2加氫制取乙醇的反應:
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
CH3CH2OH(g)+3H2O(g) △H=QkJ/mol (Q>0)
在密閉容器中,按CO2與H2的物質的量之比為1:3進行投料,在5MPa下測得不同溫度下平衡體系中各種物質的體積分數(y%)如下圖所示。完成下列填空:
(1)表示CH3CH2OH體積分數曲線的是____(選填序號)。
(2)在一定溫度下反應達到平衡的標志是 。
A.平衡常數K不再增大 B.CO2的轉化率不再增大
C.混合氣體的平均相對分子質量不再改變 D.反應物不再轉化為生成物
(3)其他條件恒定,達到平衡后,能提高H2轉化率的措施是_______(選填編號)。
A.升高溫度 B.充入更多的H2 C.移去乙醇 D.增大容器體積
(4)圖中曲線a和c的交點R對應物質的體積分數yR=_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】右圖是氫氧燃料電池構造示意圖。關于該電池說法正確的是( )。
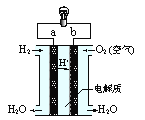
A.b是負極
B.需要點燃該電池才能開始工作
C.工作時能觀察到淡藍色火焰
D.氫氧燃料電池是一種高效環境友好的發電裝置
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組表述中,兩個微粒一定不屬于同種元素原子的是( )
A. 3p能級有一個空軌道的基態原子和核外電子排布為1s22s22p63s23p2的原子
B. M層全充滿而N層為4s2的原子和核外電子排布為1s22s22p63s23p63d64s2的原子
C. 最外層電子數是核外電子總數的1/5的原子和價電子排布為4s24p5的原子
D. 2p能級有一個未成對電子的基態原子和原子的價電子排布為2s22p5的原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學所做的有關銅元素的實驗流程如圖:

(1)寫出基態銅原子的價電子排布式________________________,向深藍色溶液中加入適量乙醇,會析出深藍色晶體,該晶體中存在的化學鍵的類型有________________________。
(2)寫出反應④的離子方程式________________________。
(3)銅能與類鹵素(SCN) 2反應生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ鍵數目為類鹵素(SCN)2對應的酸有兩種,理論推測硫氰酸(H-S-C![]() N)的沸點低于異硫氰酸(H-N=C=S)的沸點,其原因是__________________;寫出一種與SCN-互為等電子體的分子_________________(用化學式表示)。
N)的沸點低于異硫氰酸(H-N=C=S)的沸點,其原因是__________________;寫出一種與SCN-互為等電子體的分子_________________(用化學式表示)。
(4)氨基乙酸銅的分子結構如圖,碳原子的雜化方式為____________________。

(5)銅晶胞中,其晶體的堆積方式為_______________,一個晶胞中銅原子的數目為__________,空間利用率為____________(寫出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮及其化合物與人類生產、生活息息相關.回答下列問題:
(1)基態N原子中電子在2p軌道上的排布遵循的原則是__________,前4周期元素中,基態原子核外電子排布成單電子數最多的元素的價層電子排布式為__________。
(2)C、N、O三種元素第一電離能從大到小的順序是__________。
(3)N2F2分子中N原子的雜化方式是__________,l mol N2F2含有__________molσ鍵.
(4)NF3的鍵角__________NH3的鍵角(填“<”“>”或“=”),原因是__________.
(5)NH4BF4(氟硼酸銨)是合成氮化硼納米管的原料之一.l mol NH4BF4__________mol配位鍵.
(6)安全氣囊的設計原理為6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等電子體的原理是:原子總數相同,價電子總數相同的分子或離子具有相似的化學鍵特征,具有許多相近的性質.寫出兩種與N3-互為等電子體的分子或離子__________.
②Na2O的晶胞結構如圖所示,品胞邊長為566pm,晶胞中氧原子的配位數為__________,Na2O晶體的密度為__________gcm-3(只要求列算式,不必計算出結果)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com