
【題目】有三種金屬單質A、B、C,其中A的焰色反應為黃色,B、C是常見金屬。三種金屬單質A、B、C與氣體甲、乙、丙及物質D、E、F、G、H之間發生如下轉化關系(圖中有些反應的產物和反應的條件沒有標出)。

請根據以上信息回答下列問題:
(1)寫出下列物質的化學式:乙_____;B________; G_______。
(2)寫出反應②反應的化學方程式:_______;反應③的離子方程式:________。
(3)反應①-④的4個反應屬于氧化還原反應的有_________ (填選項代號)
A.①②③④ B.①②③ C.①②③ D.①③④
(4)0.1mol的金屬單質A與一定量的水完全反應,可得到標準狀況下的甲氣體_____ L,若得到的D溶液體積為100mL,則溶液的物質的量濃度為___________ 。
【答案】Cl2 Al FeCl3 2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑ Fe3++3OH-=Fe(OH)3↓ C 1.12 1mol/L
【解析】
金屬A焰色反應為黃色,故A為金屬Na,與水反應生成NaOH與氫氣,則D為NaOH,氣體甲為H2;氫氧化鈉與金屬B反應生成氫氣,故金屬B為Al;黃綠色氣體乙為Cl2;與氫氣反應生成丙為HCl,HCl溶于水得物質E為鹽酸.氫氧化鈉與物質G反應生成紅褐色沉淀H是Fe (OH) 3,故物質G中含有Fe3+,由轉化關系HCl金屬C物質F氯氣物質G,可知金屬C為Fe,物質F為FeCl2,物質G為FeCl3。
金屬A焰色反應為黃色,故A為金屬Na,與水反應生成NaOH與氫氣,則D為NaOH,氣體甲為H2;氫氧化鈉與金屬B反應生成氫氣,故金屬B為Al;黃綠色氣體乙為Cl2;與氫氣反應生成丙為HCl,HCl溶于水得物質E為鹽酸.氫氧化鈉與物質G反應生成紅褐色沉淀H是Fe (OH) 3,故物質G中含有Fe3+,由轉化關系HCl金屬C物質F氯氣物質G,可知金屬C為Fe,物質F為FeCl2,物質G為FeCl3。
(1)根據上面的分析可知,乙為Cl2,B為Al,G為FeCl3,故答案為:Cl2;Al;FeCl3;
(2)反應②反應的化學方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反應③的離子方程式為Fe3++3OH-
=Fe (OH) 3↓,故答案為:2 Al+2NaOH+2H2O=2NaAlO2+3H2↑;Fe3++3OH-=Fe (OH) 3↓;
(3) 反應①為鐵與鹽酸反應生成氫氣,是氧化還原反應,反應②為鋁與氫氧化鈉反應生成氫氣和偏鋁酸鈉,是氧化還原反應,反應③為氫氧化鈉與氯化鐵反應,是非氧化還原反應,反應④為鐵與氯化鐵反應生成氯化亞鐵,是氧化還原反應,故選C;
(4) 0.1mol的Na與一定量的水完全反應,根據電子守恒可知,得到標準狀況下的氫氣體積為0.05×22.4L=1.12L,生成氫氧化鈉的物質的量為0.1mol,若溶液體積為100mL,則溶液的物質的量濃度為![]() =1mol/L,故答案為:1.12;1mol/L。
=1mol/L,故答案為:1.12;1mol/L。


科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.硫酸氫鈉與少量氫氧化鋇反應:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.硅酸鈉溶液與醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C.鈉與水反應:Na+2H2O=Na++2OH-+H2↑
D.濃硝酸中加入過量鐵粉并加熱:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課題研究小組設計如下圖所示裝置(電極材料均為鉑),該裝置可將工業廢水中的乙胺(CH3CH2NH2)轉化成無毒無害物質。下列分析錯誤的是

A. 電極N為電池的負極
B. 電池工作時,H+由右極區通過交換膜移動到左極區
C. N電極的電極反應方程式為2CH3CH2NH2+8H2O-30e-=4CO2↑+N2↑+30H+
D. 當空氣(假設含氧氣20%)的進入量為7.5mol時,可以處理含乙胺9%(質量分數)的廢水0.1kg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是部分短周期元素的單質及其化合物(或其溶液)的轉化關系。已知在常溫常壓下,A是固體,B、C、D、E是非金屬單質且都是氣體,C呈黃綠色;化合物F是淡黃色固體,化合物G的焰色反應為黃色,化合物Ⅰ和J通常狀況下呈氣態;D和E反應生成一種刺激性氣味的氣體。
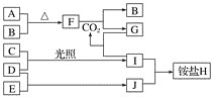
請回答下列問題:
(1)E和J的化學式分別是________和________。
(2)寫出F和CO2反應的化學方程式并用單線橋法表示電子轉移的情況:_________。
(3)將少量單質C通入盛有淀粉碘化鉀溶液的試管中,溶液變藍色,該反應的離子方程式為_________。
(4)標況下3.36 L氣體B與A完全反應,轉移電子的數目為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下面兩圖均為原電池裝置,有關說法錯誤的是( )
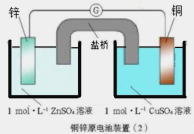
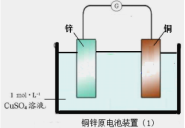
A.鋅比銅活潑,鋅為負極,發生氧化反應
B.電流從銅電極經導線流向鋅電極
C.銅電極發生的反應為:Cu-2e-= Cu2+
D.裝置(2)比裝置(1)更能清楚揭示出電池中發生的化學反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚酰亞胺是重要的特種工程材料,廣泛應用在航空、納米、激光等領域。某聚酰亞胺的合成路線如下(部分反應條件略去):

已知:
①有機物A的質譜與核磁共振氫譜圖如下:

②
③
回答下列問題:
(1)A的名稱是__________________;C中含氧官能團的名稱是________________。
(2)反應②的反應類型是____________________。
(3)反應①的化學方程式是__________________________。
(4) F的結構筒式是_____________________。
(5)同時滿足下列條件的G的同分異構體共有___________種(不含立體結構);寫出其中一種的結構簡
式:________________。
①能發生銀鏡反應 ②能發生水解反應,其水解產物之一能與FeC13溶液發生顯色反應
③1 mol該物質最多能與8 mol NaOH反應
(6) 參照上述合成路線,以間二甲苯和甲醇為原料(無機試劑任選)設計制備 的合成路線:_______________________。
的合成路線:_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下在密閉容器中發生反應:2M(g)+N(g) 2E(g)。若開始時只充入2 mol E(g),達平衡時,混合氣體的壓強比起始時增大了20%;若開始時只充入2 mol M和1 mol N的混合氣體,達到平衡的M的轉化率為
A.60%B.80%C.20%D.40%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】支撐海港碼頭基礎的鋼管柱,常用外加電流的陰極保護法進行防腐,工作原理如圖所示,其中高硅鑄鐵為惰性輔助陽極。下列有關表述不正確的是

A. 通入保護電流使鋼管樁表面腐蝕電流接近于零
B. 通電后外電路電子被強制從高硅鑄鐵流向鋼管樁
C. 高硅鑄鐵的作用是作為損耗陽極材料和傳遞電流
D. 通入的保護電流應該根據環境條件變化進行調整
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)利用如圖裝置,進行NH3與金屬氧化物MxOy反應生成M、N2、H2O,通過測量生成水的質量來測定M的相對原子質量。a中試劑是濃氨水。

①儀器a的名稱為_________,儀器b中裝入的試劑可以是___________。
②按氣流方向正確的裝置連接順序為_________(填字母,裝置可重復使用)。
(2)亞硝酸鈉是一種工業鹽,在生產、生活中應用廣泛。現用下圖所示裝置(夾持裝置已省略)及藥品,探究亞硝酸鈉與硫酸反應及氣體產物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.氣體液化的溫度:NO2(21℃)、NO(-152℃)
①反應前應打開彈簧夾,先通入一段時間氮氣,目的是________________。
②為了檢驗裝置A中生成的氣體產物,儀器的連接順序(從左向右連接):A→_________;組裝好儀器后,接下來進行的操作是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com