
【題目】反應Fe+Fe2(SO4)3=3FeSO4的能量變化趨勢如圖所示:

(1)該反應為_____(填“吸熱”或“放熱”)反應。
(2)若要使該反應的反應速率加快,下列措施可行的是_____(填字母)。
A.改鐵片為鐵粉 B.升高溫度 C.減小壓強 D.加入適量的Na2SO4固體
(3)若將上述反應設計成原電池,且銅為此原電池的某一電極材料,則銅為____(填“正”或“負”)極。Fe電極上發生的電極反應為_____,溶液中的陽離子向______(填“正”或“負”)極移動。
【答案】放熱 AB 正 Fe-2e-=Fe2+ 正
【解析】
根據反應物的總能量與生成物的總能量的相對大小判斷;增大接觸面積、增大濃度、升高溫度均可加快反應速率;Fe失去電子作負極,則Cu為正極,陽離子向正極移動,以此來解答。
(1) 圖中反應物總能量大于生成物總能量,該反應為放熱反應;
(2) A.改鐵片為鐵粉,增大接觸面積,反應速率增大,故A正確;
B.升高溫度,活化分子數增多,反應速率加快,故B正確;
C.減小壓強,體積增大,各物質濃度減小,反應速率減小,故C錯誤;
D.加入適量的Na2SO4固體不改變溶液中的H+濃度,不影響反應速率,故D錯誤;
故答案為AB;
(3) Fe比Cu活潑,則Fe失去電子作負極,則Cu為正極,Fe電極發生氧化反應,電極反應為Fe-2e-═Fe2+,溶液中的陽離子向正極移動。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列關于電解質溶液的敘述正確的是![]()
A.常溫下電離常數為Ka的酸HA溶液中 ![]()
B.將飽和![]() 溶液加入到飽和石灰水中,有白色沉淀產生,說明
溶液加入到飽和石灰水中,有白色沉淀產生,說明![]() 大于
大于![]()
C.![]() 溶液與
溶液與![]() 溶液等體積混合
溶液等體積混合![]()
D.向![]() 的氨水中加入少量硫酸銨固體,則溶液中
的氨水中加入少量硫酸銨固體,則溶液中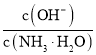 增大
增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲線如圖。下列說法不正確的是( )

A. 在曲線上任一點均存在:c(Na+)c(OH-) = c(CH3COO-)c(H+)
B. 點①所示溶液中:c(CH3COO-)+2c(OH-) = c(CH3COOH)+2c(H+)
C. 點②所示溶液中:c(Na+) = c(CH3COO-)
D. 點③所示溶液中:c(Na+) > c(OH-) > c(CH3COO-) > c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,求下列溶液的pH(已知lg2=0.3)。
(1)0.1mol·L-1的CH3COOH溶液(已知CH3COOH的電離常數Ka=1.8×10-5)。
(2)0.1mol·L-1NH3·H2O溶液(NH3·H2O的電離度為α=1%,電離度=![]() ×100%)。
×100%)。
(3)將pH=8的NaOH與pH=10的NaOH溶液等體積混合。
(4)將pH=5的鹽酸與pH=9的NaOH溶液以體積比11∶9混合。
則(1)pH=___;(2)pH=___;(3)pH=___;(4)pH=___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是( )
A.H2SO4溶液與氫氧化鈉反應:OH-+H+=H2O
B.鋁與NaOH溶液反應:Al+2OH-= ![]() +H2↑
+H2↑
C.AlCl3溶液與氨水反應:AlCl3+3OH-=Al(OH)3↓+3Cl-
D.Cl2與氫氧化鈉溶液反應:Cl2+2OH-=2ClO-+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物Y具有抗菌、消炎作用,可由X制得。
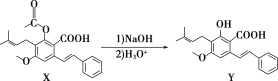
下列有關化合物X、Y的說法正確的是( )
A.1 mol X最多能與2 mol NaOH反應
B.Y與乙醇發生酯化反應可得到X
C.X、Y均能與酸性KMnO4溶液反應
D.室溫下X、Y分別與足量Br2加成的產物分子中手性碳原子數目不相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人們對苯的認識有一個不斷深化的過程。已知分子式為 C6H6的結構有多種,其中的兩種為:
Ⅰ.![]() Ⅱ.
Ⅱ.
(1)這兩種結構的化學性質區別表現在:Ⅰ不能____(填字母,下同),而Ⅱ能____。
A.被酸性KMnO4溶液氧化
B.與溴水發生加成反應
C.與氫氣發生加成反應
(2)已知Ⅰ結構下,該物質能在一定條件下與液溴反應,其反應方程式為________________。
(3)今發現C6H6還可能有另一種如下圖所示的立體結構,該結構的四氯代物有______種。
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列問題:
(1)X與Z兩元素的單質反應生成1molX的最高價化合物,恢復至室溫,放熱687kJ,已知該化合物的熔、沸點分別為 -69℃和58℃,寫出該反應的熱化學方程式___________。
(2)碳與鎂形成的1mol化合物Q與水反應,生成2molMg(OH)2和1mol烴,該烴分子中碳氫質量比為9∶1,其電子式為______________。
(3)銅與一定濃度的硝酸和硫酸的混合酸反應,生成的鹽只有硫酸銅,同時生成的兩種氣體均由表中兩種元素組成,氣體的相對分子質量都小于50。為防止污染,將產生的氣體完全轉化為最高價的含氧酸鹽,消耗1.0L 2.2molL-1NaOH溶液和1.0molO2,則兩種氣體中相對分子質量小的氣體物質的量為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.硫酸亞鐵銨晶體要用冷水洗滌,而阿斯匹林過濾后則須用無水酒精洗滌
B.食醋總酸含量的測定實驗中,若滴定終點沒有控制好,即NaOH溶液滴加過量,則必須重做實驗
C.火柴頭中的氯元素檢驗的實驗中,將火柴頭![]() 未燃燒
未燃燒![]() 浸于水中,片刻后取少量溶液,加
浸于水中,片刻后取少量溶液,加![]() 溶液、稀硝酸,若出現白色沉淀,證明有氯元素
溶液、稀硝酸,若出現白色沉淀,證明有氯元素
D.毒物誤入口內,可將![]() 稀硫酸銅溶液加入一杯溫水中內服,人工促使嘔吐出毒物后送醫院
稀硫酸銅溶液加入一杯溫水中內服,人工促使嘔吐出毒物后送醫院
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com