
【題目】用電解法可提純含有某種鉀的含氧酸鹽雜質(如硫酸鉀、碳酸鉀等)的粗KOH容液,其工作原理如圖所示。
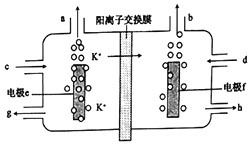
下列說法正確的是( )
A. 電極f為陽極,電極e上H+發生還原反應
B. 電極e的電極反應式為4OH--4e-=2H2O+O2↑
C. d處流進粗KOH溶液,g處流出純KOH溶液
D. b處每產生11.2L氣體,必有1molK+穿過陽離子交換膜
科目:高中化學 來源: 題型:
【題目】標準狀況下VL氨氣溶解在1L水中,所得溶液的密度為ρ g·mL-1,質量分數為ω,物質濃度為c mol·L1,則下列關系中正確的是( )
A. c=![]() B. ω=
B. ω=![]() C. ω=
C. ω=![]() D. ρ=
D. ρ=![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學概念在邏輯上存在如圖關系,對下列概念的說法正確的是( )

A. 化合物與氧化物屬于交叉關系
B. 單質與非電解質屬于包含關系
C. 溶液與分散系屬于并列關系
D. 化合物與電解質屬于包含關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧化鐵膠體的制備與其性質檢驗實驗如下,請回答下列問題。
(1)寫出制備氫氧化鐵膠體的化學方程式______________________。
(2)制備實驗操作:取一小燒杯加入25 mL蒸餾水加熱至沸騰,向沸水中逐滴加入1~2 mL____________,繼續煮沸至________________,停止加熱。
(3)證明有氫氧化鐵膠體生成的實驗操作是__________________________________。
(4)氫氧化鐵膠體穩定存在的主要原因是____________________________。
(5)氫氧化鐵膠體區別于氯化鐵溶液最本質的特征是______________________。
(6)若取少量制得的膠體加入試管中,加入硫酸銨溶液,現象是______________,這種現象稱為膠體的________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用膽礬制取氧化銅,并研究氧化銅能否在氯酸鉀受熱分解實驗中起催化作用,實驗步驟如下:①稱量ag膽礬固體放入燒杯中,加水制成溶液,向其中滴加氫氧化鈉溶液至沉淀完全;②過濾步驟①中的混合物,洗滌固體;③將②中的固體轉移至蒸發皿中,加熱至固體全部變成黑色氧化銅為止,稱量所得固體質量為bg;④取一定質量的上述氧化銅固體和一定質量的氯酸鉀固體,混合均勻后加熱,收集反應生成的氧氣(裝置如圖所示)。請回答下列問題:
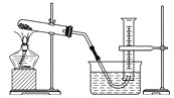
(1)上述各步操作中,需要用到玻璃棒的是________(填寫前面所述實驗步驟的序號)。
(2)由膽礬制得的氧化銅的產率(實際產量與理論產量的百分比)為________×100%。
(3)為證明氧化銅在氯酸鉀的分解反應中起催化作用,在上述實驗①~④后還應該進行的實驗操作是__________(按實驗先后順序填寫字母序號)。
a.過濾 b.烘干 c.溶解 d.洗滌 e.稱量
(4)但有很大一部分同學認為,還必須另外再設計一個實驗才能證明氧化銅在氯酸鉀受熱分解的實驗中起催化作用。你認為還應該進行的另一個實驗是____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亞銅都是重要的半導體化合物。回答下列問題:
(1)基態鉻原子的核外電子排布式為___________,其中未成對電子數為____________。
(2) Ge-GaAs中元素Ge、Ga、As的第一電離能從大到小的順序為_______________。ZnGeAs2中Zn、Ge、As的電負性從大到小的順序為________________。
(3)聚吡咯的單體為吡咯(![]() ),該分子中氮原子的雜化軌道類型為__________;分子中σ鍵與π鍵的數目之比為________________。
),該分子中氮原子的雜化軌道類型為__________;分子中σ鍵與π鍵的數目之比為________________。
(4)碳化硅、晶體硅及金剛石的熔點如下表:
立方碳化硅 | 晶體硅 | 金剛石 | |
熔點/℃ | 2973 | 1410 | 3550~4000 |
分析熔點變化規律及其差異的原因:__________________________________________________。
(5)氧化亞銅的熔點為1235℃,其固態時的單晶胞如下圖所示。
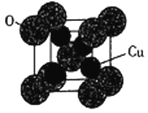
①氧化亞銅屬于__________晶體。
②已知Cu2O的晶胞參數a=425.8pm,則其密度為__________ g·cm-3(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在體積為V L的密閉容器中發生化學反應CO(g)+2H2(g)![]() CH3OH(g),可判斷該可逆反應達到化學平衡狀態的標志是
CH3OH(g),可判斷該可逆反應達到化學平衡狀態的標志是
A. v生成(CH3OH)=v消耗(CO)
B. 混合氣體的密度不再改變
C. 混合氣體的平均相對分子質量不再改變
D. CO、H2、CH3OH的濃度比為1:2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】五氯化磷(PCl5)常溫下是一種淡黃色固體,在潮濕空氣中水解產生兩種酸。PCl5在有機合成中被廣泛用作氯化劑、催化劑、脫水劑等,高純度PCl5主要用于醫藥中間體及鋰電池原材料的合成。工業生產PCl5的傳統方法是在攪拌式反應釜中注入液體三氯化磷(PCl3),再通入氯氣在合適的溫度下發生反應:PCl3+Cl2![]() PCl5。某工廠對傳統方法進行了改進以生產高純度PCl5,主要流程如下圖所示(循環水的作用是控制溫度)。
PCl5。某工廠對傳統方法進行了改進以生產高純度PCl5,主要流程如下圖所示(循環水的作用是控制溫度)。
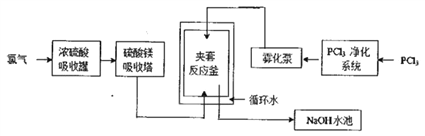
請回答下列相關問題。
(1)工業生產氯氣的主要方法的離子方程式是___________,利用該反應所得產品可繼續生產_________(任寫一種)等化工產品。
(2)濃硫酸吸收罐和硫酸鎂吸收塔的作用是______________________,若去掉這兩個設備夾套反應釜中發生的主要副反應是______________________________。
(3)夾套反應釜中的原料混合方式與攪拌式反應釜相比主要優點是____________________________。 (4)NaOH水池的作用是_______________________,從降低生產成本的角度考慮NaOH溶液可更換為______。
(5)生產過程中PCl3的加料速率會對生產造成明顯的影響,具體情況如下表。根據表中數據判斷最佳的加料速率范圍是_________________kg·h-1。
PCl3加料速率/kg·h-1 | PCl5狀態 | 熱交換情況 | 生產500kg產品的周期/h |
40 | 致密、堅硬、造粒困難 | 快、溫度可控 | 11.5 |
50 | 致密、堅硬、造粒困難 | 快、溫度可控 | 9.2 |
60 | 較松散、造粒容易 | 較快、溫度可控 | 7.2 |
70 | 松散、造粒容易 | 較快、溫度可控 | 6.5 |
80 | 松散、造粒容易 | 慢、溫度升高難以控制 | 5.3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com