
【題目】(1)在25 ℃下,向濃度均為0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化學式),生成該沉淀的離子方程式為___________。已知25 ℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,當兩種沉淀共存時,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度積常數Ksp=1.1×10-36。室溫時在FeCl3溶液中滴加NaOH溶液,當溶液pH為3時,通過計算說明Fe3+是否沉淀完全_______________________。(提示:當某離子濃度小于10-5 mol·L-1時可以認為該離子沉淀完全)
【答案】 Cu(OH)2 Cu2++2NH3·H2O===Cu(OH)2↓+2 NH4+ 2.7×10-3 c(Fe3+)=Ksp/c3(OH-)=1.1×10-3 mol·L-1>1×10-5 mol·L-1,故Fe3+沒有沉淀完全
【解析】試題分析:本題考查與溶度積有關的計算。
(1)Mg(OH)2和Cu(OH)2的類型相同,Ksp[Mg(OH)2] ![]() Ksp[Cu(OH)2],開始溶液中Mg2+和Cu2+濃度相等,加入氨水先達到Cu(OH)2的溶度積,則加入氨水先生成Cu(OH)2沉淀,反應的離子方程式為Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
Ksp[Cu(OH)2],開始溶液中Mg2+和Cu2+濃度相等,加入氨水先達到Cu(OH)2的溶度積,則加入氨水先生成Cu(OH)2沉淀,反應的離子方程式為Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
(2)因為兩種沉淀共存,則溶液中c(Ag+)·c(Br-)=Ksp(AgBr),c(Ag+)·c(Cl-)=Ksp(AgCl),![]() =2.7
=2.7![]() 10-3。
10-3。
(3)pH=3時溶液中c(OH-)=1![]() 10-14
10-14![]() (1
(1![]() 10-3)=1
10-3)=1![]() 10-11mol/L,c(Fe3+)=Ksp/c3(OH-)=1.1
10-11mol/L,c(Fe3+)=Ksp/c3(OH-)=1.1![]() 10-36
10-36![]() (1
(1![]() 10-11)3=1.1
10-11)3=1.1![]() 10-3mol/L
10-3mol/L![]() 1
1![]() 10-5mol/L,Fe3+沒有沉淀完全。
10-5mol/L,Fe3+沒有沉淀完全。


科目:高中化學 來源: 題型:
【題目】關于烷烴性質的敘述,錯誤的是
A. 烷烴不能使酸性高錳酸鉀溶液褪色
B. 烷烴都能燃燒
C. 烷烴在水中的溶解度隨著碳原子數的增加而增大
D. 烷烴都能發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用98%的濃硫酸(ρ=1.84 g/cm3)配制1 mol/L稀硫酸100 mL。
(1)實驗操作:
a.用100mL量筒量取98%的濃硫酸___________mL;
b.選取對應規格的容量瓶,洗滌,檢查是否漏液,將稀釋并冷卻至室溫的硫酸溶液沿玻璃棒轉移到此容量瓶中;
c.用少量蒸餾水洗滌小燒杯和玻璃棒2~3次,并將洗滌液轉移到容量瓶中;
d.在小燒杯內稀釋濃硫酸,稀釋時要用玻璃棒不斷攪拌;
e.向容量瓶中直接加蒸餾水至離刻度線1~2 cm處;
f.蓋上容量瓶瓶塞,搖勻;
g.用膠頭滴管小心加蒸餾水至刻度線;
h.將配制好的溶液轉移入含少量蒸餾水的試劑瓶中貯存備用。
(2)實驗
①正確的操作步驟是__________________________________________________(填序號)。
②此實驗中玻璃棒的作用是__________________________________________________。
③實驗操作中有兩處錯誤,這兩處錯誤是:________________________、_________________________。
(3)下列操作對所配溶液的濃度有何影響?(填“偏高”“偏低”或“無影響”)
①量取濃硫酸的量筒用蒸餾水洗滌兩次,并將洗滌液轉入容量瓶中______________。
②定容時俯視容量瓶刻度線________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,將224 L氯化氫氣體溶于635 mL的水(密度為1.00 g/cm3)中,所得鹽酸的密度為1.18 g/cm3。求:
(1)該鹽酸的溶質質量分數是多少?______________
(2)取這種鹽酸10.0 mL,稀釋到1.00 L,所得的稀鹽酸的物質的量濃度多少?____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以硅孔雀石(主要成分為 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等雜質)為原料制備CuCl2的工藝流程如下:
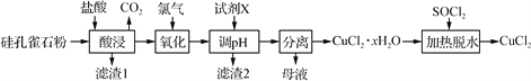
(1)為提高“酸浸”時銅元素的浸出率,可以采取的措施有:
①適當加快攪拌速率;②______________。(任答一點即可)
(2)“氧化”時發生反應的離子方程式為__________。
(3)“濾渣1”的主要成分為SiO2和H2SiO3等,“濾渣2”的主要成分為______(填化學式);試劑X可選擇_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“調pH”時,pH不能過高,其原因是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酒后駕車是馬路上的第一大殺手。已知酒精(C2H5OH)能與K2Cr2O7和H2SO4的混合溶液在一定條件下發生如下反應:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分別顯橙色和綠色,回答下列問題:
(1)該反應________(填“是”或“不是”)離子反應。
(2)寫出Cr2(SO4)3的電離方程式:______________________________________。
(3)該反應________(填“是”或“不是”)氧化還原反應,判斷的依據是_________________________________。
(4)你認為能否用這一反應來檢測司機是否酒后駕車?________(填“能”或“不能” ),簡述其原理________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)寫出下列反應的化學方程式,用雙線橋法標明電子轉移的方向和數目,并注明“被氧化”、“被還原”。
①Fe2O3與CO在高溫下的反應:___________________________________。
②KClO3與MnO2在共熱條件下反應:________________________________。
③H2S氣體和SO2氣體反應生成S和水:______________________________。
(2)寫出下列反應的離子方程式,并用單線橋法標明電子轉移的方向和數目。
①Cu和AgNO3溶液反應:________________________________________。
②實驗室制Cl2的反應為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O:___________________________。
MnCl2+Cl2↑+2H2O:___________________________。
③向FeCl2溶液中通入Cl2生成FeCl3:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用下圖裝置進行實驗,甲、乙兩池中均為1 mol·L-1的AgNO3溶液,A、B均為Ag電極。實驗開始時先閉合K1,斷開K2。一段時間后,斷開K1,閉合K2,形成濃差電池,電流表指針偏轉(Ag+濃度越大氧化性越強)。下列說法不正確的是( )

A. 閉合K1,斷開K2后,A電極增重
B. 閉合K1,斷開K2后,乙池溶液濃度上升
C. 斷開K1,閉合K2后,A電極發生氧化反應
D. 斷開K1,閉合K2后,NO![]() 向B電極移動
向B電極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C都是元素周期表中的短周期元素,它們的核電荷數依次增大。第2周期元素A原子的核外成對電子數是未成對電子數的2倍,B原子的最外層p軌道的電子為半充滿結構,C是地殼中含量最多的元素。D是第四周期元素,其原子核外最外層電子數與氫原子相同,其余各層電子均充滿。請用對應的元素符號或化學式填空:
(1)A、B、C的第一電離能由小到大的順序為 。
(2)A的最高價含氧酸根離子中其中心原子采取 雜化。
(3)與A、B形成的陰離子(AB-)互為等電子體的分子有 。
(4)基態D原子的核外電子排布式為 ,下圖是金屬Ca和D所形成的某種合金的晶胞結構示意圖,則該合金中Ca和D的原子個數比為 。

(5)向D的高價態硫酸鹽溶液中逐滴滴加B的氫化物水溶液至過量,先出現沉淀,最后沉淀溶解形成溶液。寫出此沉淀溶解的離子方程式:_ ___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com