
【題目】將某淺黃色固體(由X、Y兩種元素組成)和焦炭混合,加熱,發生反應,其裝置如圖所示。先通入氮氣,再點燃I、Ⅲ中的酒精燈,實驗中觀察到I中生成銀白色金屬,Ⅱ、Ⅳ中溶液變渾濁、Ⅲ中黑色粉末變成紅色。下列敘述不正確的是
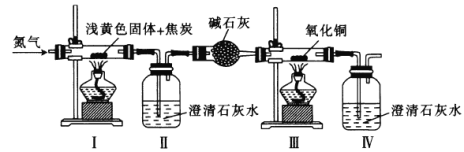
A.X可能是鈉元素,Y一定是氧元素
B.淺黃色固體與焦炭在高溫下反應生成CO2和CO
C.先通入氮氣的目的是排盡裝置中的空氣
D.用燃燒法處理Ⅳ排放的尾氣
 輕松暑假總復習系列答案
輕松暑假總復習系列答案科目:高中化學 來源: 題型:
【題目】在一密閉容器中,反應aA(g)![]() bB(g)達平衡后,保持溫度不變,將容器體積增加一倍,將達到新的平衡時,B的濃度是原來的60%,則
bB(g)達平衡后,保持溫度不變,將容器體積增加一倍,將達到新的平衡時,B的濃度是原來的60%,則
A.平衡向逆反應方向移動了
B.物質A的轉化率減小了
C.物質B的質量分數增加了
D.a>b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】欲用18.4mol·L-1的濃硫酸配制250 mL 0.2 mol·L-1的硫酸溶液,完成下列問題:
(1)所需的主要儀器有__________________________________________________。
(2)根據計算,所取18.4mol·L-1的濃硫酸的體積為________mL,稀釋濃硫酸的正確操作方法是____________________________________________________________。
(3)下列操作會使所配制硫酸濃度偏低的是________。
A.轉移溶液時未洗滌燒杯與玻璃棒
B.容量瓶水洗后未干燥
C.定容時加水越過刻度線
D.定容時仰視刻度線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.(1)下列物質中,屬于電解質的是________,(填序號,下同);能導電的是________。
①H2SO4 ②鹽酸 ③氯氣 ④硫酸鋇 ⑤乙醇 ⑥銅 ⑦熔融的NaCl ⑧蔗糖 ⑨空氣 ⑩CO2
II. 按要求回答下列問題
(2)硫酸鋁(寫出電離方程式)_______________。
(3)CuSO4溶液與Ba(OH)2溶液混合(寫出離子方程式)_______。
(4)實驗室用高錳酸鉀制氧氣(寫化學反應方程式并用單線橋表示電子轉移方向和數目)_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、X均為短周期元素形成的無機物,存在下圖所示轉化關系(部分生成物和反應條件略去);已知A 由短周期非金屬元素組成,B具有漂白性且光照易分解。請回答以下問題:
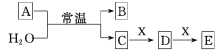
(1)若A為單質,且C為一元強酸。
①寫出一種工業制備單質A的離子方程式: ____________________。
②X可能為________(填字母代號)。
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A為兩種元素形成的化合物,且E與水反應生成的G的濃溶液遇C有白煙產生。
①A與H2O反應的化學方程式為_____________________________。
②室溫下,NH2OH(羥氨)會發生分解生成C、D,試寫出其分解反應的化學方程式_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷酸二氫鉀(KH2PO4)在工業、農業、醫藥及食品等行業均有廣泛的應用。利用氟磷灰石(化學式為Ca5P3FO12)制備磷酸二氫鉀的工藝流程如圖所示(部分流程步驟已省略):
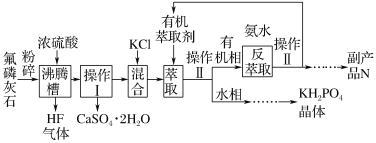
其中,萃取是因為KCl和H3PO4產生的HCl易溶于有機萃取劑。請回答下列問題:
(1)氟磷灰石(Ca5P3FO12)中磷元素的化合價是____。
(2)用化學反應原理解釋KCl和H3PO4生成KH2PO4的原因: ________。
(3)沸騰槽不能采用陶瓷材質的原因是_______(用化學方程式表示)。
(4)在得到N的流程中“……”的操作步驟是______、洗滌、干燥。
(5)在萃取過程中,影響萃取率的因素復雜,下圖是投料比![]() 對萃取率的影響曲線,在實際操作中,應選擇投料比
對萃取率的影響曲線,在實際操作中,應選擇投料比![]() 的范圍是___(填序號)。
的范圍是___(填序號)。
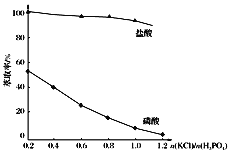
A.0.2~0.4 B.0.4~0.6 C.0.6~0.8 D.0.8~1.0 E.1.0~1.2
(6)電解法制備KH2PO4是用石墨作電極,將電解槽分為a區和b區,中間用陽離子交換膜隔離,a區為3 mol·L-1 H3PO4,b區為3 mol·L-1 KCl。陽極區為____(填“a”或“b”)區,其電極反應式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組欲測定室溫下(25 ℃、101 kPa)的氣體摩爾體積。該小組設計的簡易實驗裝置如圖所示:
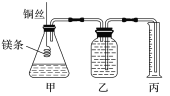
該實驗的主要操作步驟如下:
①用已知濃度的濃鹽酸配制100 mL 1.0 mol·L-1的鹽酸(需要用到的儀器有:量筒、玻璃棒、燒杯、____________;
②用10 mL的量筒量取8.0 mL 1.0 mol·L-1的鹽酸加入錐形瓶中;
③準確稱取a g已除去表面氧化膜的鎂條,并系于銅絲末端,為使HCl全部參加反應,a的數值至少為___________;
④往廣口瓶中裝入足量水,按上圖連接好裝置,檢查裝置的氣密性;
⑤反應結束后待體系溫度恢復到室溫,讀出量筒中水的體積為V mL。
請回答下列問題:
(1)步驟①中,配制100 mL 1.0 mol·L-1的鹽酸時,下列會使所配制溶液的濃度偏小的操作有_________(填字母)。
A.用量筒量取濃鹽酸時,俯視量筒的刻度線
B.容量瓶未干燥即用來配制溶液
C.濃鹽酸在燒杯中稀釋時,攪拌時間過長
D.定容完成后,將容量瓶倒置搖勻后,發現液面低于刻度線未做處理
E.在容量瓶中定容時俯視容量瓶刻度線
F.燒杯中有少量水
G.未冷卻至室溫即定容
(2)請填寫操作步驟中的空格:
步驟①:_________________________;
步驟③:________________________。
(3)實驗步驟⑤中應選用的量筒規格是_______。
(4)讀數時除需要恢復至室溫外,還需要注意(回答一點即可):___________________________。
(5)忽略水蒸氣影響,在該條件下測得氣體摩爾體積的計算式為Vm=________L·mol-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年是“國際化學元素周期表年”。1869年門捷列夫把當時已知的元素根據物理、化學性質進行排列,準確預留了甲、乙兩種未知元素的位置,并預測了二者的相對原子質量,部分原始記錄如下:

下列說法不正確的是
A.元素甲位于現行元素周期表第四周期第ⅢA族
B.元素乙的簡單氣態氫化物的穩定性強于CH4
C.原子半徑比較:甲>乙>Si
D.推測乙可以用作半導體材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等體積,不同濃度的NaCl、MgCl2、AlCl3三種溶液分別與等體積等物質和量濃度的AgNO3溶液恰好完全反應,則NaCl、MgCl2、AlCl3三種溶液中Cl-的物質的量濃度之比是
A.1:2:3B.3:2:1C.6:3:2D.1:1:1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com