
【題目】(1)某元素原子M層電子數是K層電子數的一半,該元素的原子結構示意圖是______________。
(2)碘的質子數為53,碘有多種核素,其中中子數為74的核素的原子符號是________。
(3)某陽離子ARn+,核外共有x個電子,則該原子核內的中子數為 __________。
【答案】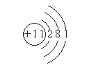
![]() A―x―n
A―x―n
【解析】
(1)根據元素核外電子排布規律進行分析;
(2)根據質量數=中子數+質子數計算;
(3)根據中子數=質量數-質子數及陽離子核外電子數=質子數-|所帶電荷數|。
(1)元素原子核外M層電子數是K層電子數的一半,說明元素原子有三個電子層,從內到外每一個電子層上的電子數分別為2、8、1,所以元素原子的原子序數為11,為鈉元素,所以鈉原子的原子結構示意圖為: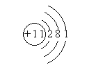 ;
;
(2)碘的質子數為53,中子數為74的核素,質量數為53+74=127,核素的原子符號可表示為![]() ;
;
(3)某陽離子ARn+,核外共有x個電子,則該原子核內的質子數為x+n,中子數=質量數-質子數=A-(x+n)=A-x-n。


科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的數值。下列的說法中,正確的是( )
A. 4.6g金屬鈉由原子完全變為Na+ 離子時,失去的電子數為0.1NA
B. NA 個氧氣分子與NA 個氫氣分子的質量比為8︰1
C. 0.2 NA個硫酸分子與19.6g磷酸(相對分子質量:98)含有相同的氧原子數
D. 22.4L的氮氣所含有的原子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向20mL某物質的量濃度的AlCl3溶液中滴加2mol/LNaOH溶液時,逐滴加入NaOH溶液直至過量。經測定,加入的NaOH溶液的體積(mL)和所得沉淀的物質的量(mol)的關系如圖所示。則:
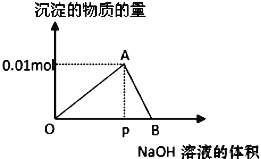
(1)寫出OA段發生反應的離子方程式:OA段___,圖中線段OP:PB=__,
(2)計算原AlCl3溶液的物質的量濃度為__mol/L,
(3)圖中A對應的橫坐標為__mL,
(4)當加入5mLNaOH溶液時,產生沉淀量為__mol,
(5)當加入的NaOH溶液過量時,使最初生成的沉淀部分溶解,要得到與(4)中相同的沉淀量,加入NaOH溶液的體積為__mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以CO2和H2為原料制取乙醇的反應為 2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g) ΔH<0。某壓強下 的密閉容器中,按CO2和H2的物質的量比為 1∶3 投料,不同溫度下,達到平衡后平衡體系中各物質的物質的量分數(y%)隨溫度變化如圖所示。下列說法正確的是
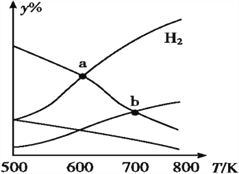
A. a點的平衡常數小于b點 B. b點:v正(CO2)=v逆(H2O)
C. a點:n(H2)=n(H2O) D. 溫度不變,充入更多H2,v(CO2)始終不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲線如圖。下列說法正確的是()
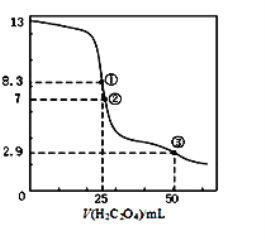
A.點①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.點②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.點③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定過程中可能出現:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、下表是元素周期表的一部分。表中所列的字母分別代表一種化學元素。

(1)寫出基態時Q元素原子的電子排布式__________,J元素原子的外圍電子排布圖________________。
(2)下列對比正確的是__________。
a.原子半徑H>G>B>A b.第一電離能E>D>C>B
c.電負性A>H>G>Q d.最高價氧化物的水化物酸性B>A>H>G
(3)關于元素在元素周期表中的位置以及元素原子的外圍電子排布特點的有關敘述不正確的是______。
a.L位于元素周期表第五周期ⅠA族,屬于s區元素
b.O位于元素周期表第七周期Ⅷ族,屬于ds區元素
c.M的外圍電子排布式為6s1,屬于ds區元素
d.H所在族的外圍電子排布式為ns2np2,屬于p區元素
Ⅱ、已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它們的原子序數依次增大。A是元素周期表中原子半徑最小的元素,D3B中陰、陽離子具有相同的電子層結構,B、C均可分別與A形成10電子分子,B、C屬同一周期,兩者可以形成許多種共價化合物,C、F屬同一主族,B原子最外電子層的p能級上的電子處于半滿狀態,C的最外層電子數是內層電子數的3倍,E最外層電子數比最內層多1。請用具體的元素回答下列問題:
(4)F、G元素對應的最高價含氧酸中酸性較強的化學式為__________。
(5)第一電離能:B__________C,電負性:C__________F。(填“<”、“>”或“=”)
(6)A、C形成的一種綠色氧化劑X有廣泛應用,X分子中A、C原子個數比為1∶1,X的電子式為____________,試寫出Cu、稀硫酸與X反應制備硫酸銅的離子方程式__________。
(7)寫出E與D的最高價氧化物對應的水化物反應的化學方程式______________________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)由N2、NO、CO2組成的混合氣體中,三種成分的體積分數之比為1:2:1,則三種成分的質量比為________。
(2)等質量的鈉和鎂分別與足量的稀硫酸反應,放出氣體的體積(同溫同壓)之比為________。
(3)同溫同壓下,某容器充滿CO2重122 g,充滿NO氣體重115 g,現充滿某氣體B重123 g,則該氣體的相對分子質量為_____。
(4)有15 g A物質和10.5 g B物質恰好完全反應生成7.2 g C物質、1.8 g D物質和0.3 mol E物質,則E物質的摩爾質量是_____g·mol-1。
(5)標準狀況下,10 mL N2氣體恰好與30 mL H2完全反應生成20 mL氣體A,則A的分子式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是
A.將銅片插入稀硝酸中:![]()
B.稀硫酸與Ba(OH)2溶液反應:![]()
C.向A12(SO4)3溶液中加入過量氨水:![]()
D.向Na2SiO3溶液中滴加醋酸:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】E和F加入密閉容器中,在一定條件下發生反應:E(s)+4F(g)![]() G(g),已知該反應的平衡常數值如下表所示。下列說法正確的是
G(g),已知該反應的平衡常數值如下表所示。下列說法正確的是
溫度℃ | 25 | 80 | 230 |
平衡常數值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反應是熵增反應
B.25℃時,反應G(g)![]() E(s)+4F(g)的平衡常數值是0.5
E(s)+4F(g)的平衡常數值是0.5
C.在80℃時,測得某時刻,F、G濃度均為0.5 mol·L﹣1,則此時v(正)>v(逆)
D.恒溫恒容下,向容器中再充入少量G(g),達新平衡時,G的體積百分含量將增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com