
【題目】下列反應的離子方程式正確的是( )
A. 醋酸與氫氧化鈉溶液反應:H++ OH-= H2O
B. 碳酸氫鈉水解的離子方程式:HCO3-+ H2O ![]() H3O+ + CO32-
H3O+ + CO32-
C. 用FeCl3溶液腐蝕印刷電路板:Fe3++Cu=Fe2++Cu2+
D. 用小蘇打治療胃酸過多:HCO3-+H+=CO2↑+H2O
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】如圖所示,甲池的總反應式為N2H4+O2===N2+2H2O。下列說法正確的是
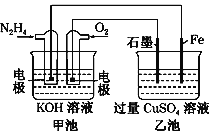
A. 乙池中Fe電極上發生氧化反應
B. 乙池中石墨電極上發生的反應可寫為4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH減小
D. 甲池中每消耗0.1 mol N2H4乙池電極上則會析出6.4 g固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅焙砂是鋅精礦經焙燒后所得的產物,以鋅焙砂為原料制取金屬鋅的流程如圖所示。
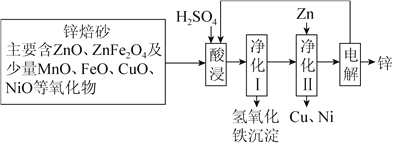
已知:①當溶液中Zn2+濃度較大時,Zn2+優先于H+放電。
②堿性條件下Mn(Ⅱ)可以被氧氣氧化生成Mn(Ⅵ)。
請回答下列問題:
(1)酸浸時ZnFe2O4會生成兩種鹽,該反應的化學方程式為_____________________________。
(2)凈化Ⅰ操作分為兩步:第一步是將溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+轉化為Fe(OH)3沉淀。
①寫出酸性條件下H2O2與Fe2+反應的離子方程式:___________。
②25 ℃時,pH=3的濾液(濾去氫氧化鐵沉淀)中,c(Fe3+)=________mol·L-1(已知25 ℃時,Ksp[Fe(OH)3]=4.0×10-38)。
(3)電解硫酸鋅溶液時陽極上有氣體析出,寫出陽極的電極反應式_____________________________;
電解時不斷補充電解液的目的是_________________________。
(4)電解時,陽極附近發生化學反應生成HMnO4,使得溶液變為紫紅色,生成的HMnO4,又將Mn2+氧化生成MnO2,一部分二氧化錳沉于槽底形成陽極泥,另一部分附于陽極表面形成保護膜。寫出HMnO4將Mn2+氧化生成MnO2的化學方程式__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知0.1 mol·L-1的醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量燒堿溶液 ②升高溫度 ③加少量冰醋酸 ④加水
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按右下圖裝置進行實驗,下列描述正確的是(N裝置中兩個電極均為石墨棒)( )

A. C1上發生還原反應
B. M 裝置中SO42-移向Cu電極
C. 工作一段時間后裝置M 中溶液pH變小,裝置N中溶液pH變大
D. Cu電極與C2電極上的電極反應相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把 NaOH、MgCl2、AlCl3 三種固體組成的混合物溶于足量水后,產生 1.16g 白色沉淀, 再向所得濁液中逐漸加入 2.00mol/LHCl 溶液,加入HCl 溶液的體積與生成沉淀的關系如圖所示。
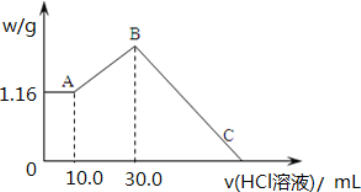
(1)A 點沉淀物的化學式為_____。B 點縱坐標為___________________。
(2)A 點至B 點改為通入二氧化碳氣體,至少須標準狀況下二氧化碳_____mL。此時發生反應的離子方程式為_____。
(3)B 點含溶質的物質的量是_____mol。C 點(此時沉淀恰好完全溶解)HCl 溶液的體積為_____mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA表示阿伏加德羅常數的數值,下列敘述中正確的是( )
A. 物質的量就是指物質的多少
B. 24g金屬鎂變為鎂離子時失去的電子數為NA
C. 常溫常壓下,48g O3含有的氧原子數為3NA
D. 同溫同壓下,NA個NO與NA個N2和O2的混合氣體的體積不相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將物質X逐漸加入Y溶液中,生成沉淀物質的量n2與所加X的物質的量n1的關系如圖所示。符合圖所示情況的是
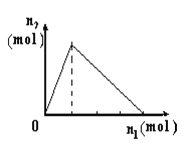
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,將2molA和3molB充入一密閉的容器中發生反應:aA(g)+B(g)![]() C(g)+D(g),5 min后達平衡。已知該反應在此溫度下平衡常數K=1,若溫度不變的情況下將容器的體積擴大為原來的10倍,A的轉化率不發生變化,則
C(g)+D(g),5 min后達平衡。已知該反應在此溫度下平衡常數K=1,若溫度不變的情況下將容器的體積擴大為原來的10倍,A的轉化率不發生變化,則
A. a="3" B. a="2" C. B的轉化率為40% D. B的轉化率為60%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com