
【題目】鉻及其化合物在工農業生產中具有廣泛應用,請回答下列問題:
(1)基態鉻原子的核外電子排布式為_____________。
(2)Cr3+能形成配離子[Cr(H2O)(H2NCH2CH2NH2)]3+,在配體H2NCH2CH2NH2 中采用 sp3雜化的原子有_____。
(3)氯化鉻酰(CrO2Cl2)熔點:-96.5℃,沸點:117℃,能與 CS2 等互溶.則固態 CrO2Cl2屬于________晶體。已知 NO2+與 CS2 互為等電子體,則 1molNO2+中含有π鍵數目為 ____________
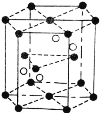
(4)Cr2O3 晶胞結構如圖所示,已知 Cr2O3 的摩爾質量為 M g/mol,晶體的密度為ρ g·cm-3 ,晶胞體積為 V cm3. 晶胞結構示意圖中的小黑球代表_____(填“鉻離子”或“氧離子”),阿伏加德羅常數NA=_________mol-1(用含 M, V, ρ的代數式表示 )。
【答案】[Ar]3d54s1 C、N 分子 2NA 氧離子 ![]()
【解析】
(1)Cr為24號元素,其原子核外有24個電子,根據構造原理書寫基態鉻原子的核外電子排布式;
(2)在配體H2NCH2CH2NH2中采用sp3雜化的原子價層電子對個數是4;
(3)分子晶體熔沸點較低;NO2+與CS2互為等電子體,等電子體結構相似,二硫化碳分子中含有2個π鍵,則1個NO2+中含有π鍵數目為2;
(4)該晶胞中黑色球個數=12×![]() +2×
+2×![]() +3=6、白色球個數為4,則黑色球、白色球個數之比=6:4=3:2,其化學式為Cr2O3,據此判斷黑色球代表離子;根據晶體密度ρ=
+3=6、白色球個數為4,則黑色球、白色球個數之比=6:4=3:2,其化學式為Cr2O3,據此判斷黑色球代表離子;根據晶體密度ρ=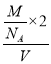 計算NA。
計算NA。
(1)Cr為24號元素,其原子核外有24個電子,根據構造原理書寫基態鉻原子的核外電子排布式為1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)在配體H2NCH2CH2NH2中采用sp3雜化的原子價層電子對個數是4,C、D原子價層電子對個數都是4,所以采用sp3雜化的原子有C、N;
(3)分子晶體熔沸點較低,該物質熔沸點較低,為分子晶體;NO2+與CS2互為等電子體,等電子體結構相似,二硫化碳分子中含有2個π鍵,則1個NO2+中含有π鍵數目為2,所以1molNO2+中含有π鍵數目為2NA;
(4)該晶胞中黑色球個數=12×![]() +2×
+2×![]() +3=6、白色球個數為4,則黑色球、白色球個數之比=6:4=3:2,其化學式為Cr2O3,據此判斷黑色球代表離子為氧離子;根據晶體密度ρ=
+3=6、白色球個數為4,則黑色球、白色球個數之比=6:4=3:2,其化學式為Cr2O3,據此判斷黑色球代表離子為氧離子;根據晶體密度ρ=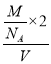 得NA=
得NA=![]() /mol。
/mol。


科目:高中化學 來源: 題型:
【題目】為了除去KCl溶液中少量的MgCl2、MgSO4,從稀鹽酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,選擇A、B、C三種試劑,按圖中的實驗步驟進行操作:
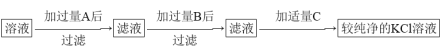
(1)B的化學式_________。
(2)加過量A的原因是________,有關反應的化學方程式為__________;____________。
(3)加過量B的原因是____________,有關反應的化學方程式為________;_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】興趣小組探究SO2氣體還原Fe3+、I2,它們使用的藥品和裝置如圖所示:
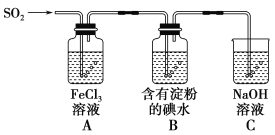
(1)SO2氣體和Fe3+反應的氧化產物、還原產物分別是________、________
(2)下列實驗方案適用于在實驗室制取所需SO2的是________。
A.Na2SO3溶液與HNO3 B.Na2SO3固體與濃硫酸
C.固體硫在純氧中燃燒 D.銅與濃H2SO4共熱
(3)裝置C的作用是__________________________________________________。
(4)裝置B中反應的離子方程式_________________________________________________。
(5)在上述裝置中通入過量的SO2,為了驗證A中SO2與Fe3+發生了氧化還原反應,他們取A中的溶液,分成三份,并設計了如下實驗:
方案①:往第一份試液中加入酸性KMnO4溶液,紫紅色褪去。
方案②:往第二份試液中加入NaOH溶液,產生白色沉淀,并迅速轉為灰綠,最后呈紅褐色。
方案③:往第三份試液中加入用稀鹽酸酸化的BaCl2,產生白色沉淀。
上述方案不合理的是方案_____,原因是__________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是模擬“侯氏制堿法”制取NaHCO3的部分裝置。下列操作正確的是( )

A. a通入CO2,然后b通入NH3,c中放堿石灰
B. b通入NH3,然后a通入CO2,c中放堿石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脫脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脫脂棉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組設計了如圖所示的實驗裝置,既可用于制取氣體,又可用于驗證物質的性質。
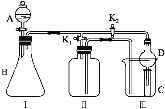
(1)打開K1關閉K2,可制取某些氣體。甲同學認為裝置Ⅰ可用于制取H2、NH3、O2,但裝置Ⅱ只能收集H2、NH3,不能收集O2。其理由是_____。乙同學認為在不改動裝置Ⅱ儀器的前提下,對裝置Ⅱ進行適當改進,也可收集O2。你認為他的改進方法是_____。
(2)打開K2關閉K1,能比較一些物質的性質。丙同學設計實驗比較氧化性:KClO3>Cl2>Br2。在A中加濃鹽酸后一段時間,觀察到C中的現象是______;儀器D在該裝置中的作用是_______。在B裝置中發生反應的離子方程式為______。丁同學用石灰石、醋酸、苯酚鈉等藥品設計了另一實驗。他的實驗目的是_____。
(3)實驗室常用濃H2SO4與硝酸鈉反應制取HNO3。下列裝置中最適合制取HNO3的是_____。實驗室里貯存濃硝酸的方法是_______。
a 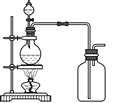 b
b 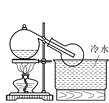 c
c 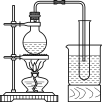 d
d 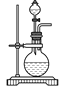
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫下,物質的量之比為2∶1的SO2和O2的混合氣體在容積為2 L的恒容密閉容器中發生反應:2SO2(g)+O2(g)![]() 2SO3(g)(正反應為放熱反應),n(SO2)隨時間變化關系如下表:
2SO3(g)(正反應為放熱反應),n(SO2)隨時間變化關系如下表:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列說法正確的是( )
A. 當容器中氣體的密度不變時,該反應達到平衡狀態
B. 該反應進行到第3分鐘時,逆反應速率小于正反應速率
C. 從反應開始到達到平衡,用SO3表示的平均反應速率為0.01 mol/(L·min)
D. 容器內達到平衡狀態時的壓強與起始時的壓強之比為5∶4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH變化如圖所示(忽略溫度變化),已知:常溫下,H2X的電離常數Ka1=1.1×10-5,Ka2=1.3×10-8。下列敘述正確的是
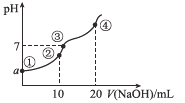
A.a近似等于3
B.點②處c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.點③處為H2X和NaOH中和反應的滴定終點
D.點④處c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1.0 L恒容密閉容器中投入1 mol CO2和2.75 mol H2發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖所示。下列說法正確的是
CH3OH(g)+H2O(g),實驗測得不同溫度及壓強下,平衡時甲醇的物質的量變化如圖所示。下列說法正確的是
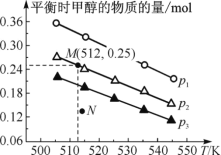
A. 該反應的正反應為放熱反應
B. 壓強大小關系:p1<p2<p3
C. M點對應的平衡常數K的值約為 1.04×10-2
D. 在p2及512 K時,圖中N點v(正)<v(逆)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com