
【題目】中醫典籍《肘后備急方》所載治療瘧疾的方法“青蒿一握,以水二升漬,絞取汁,盡服之”, 對屠呦呦團隊研發治療瘧疾的特效藥——青蒿素有巨大的啟示作用。屠呦呦在對比實驗中發現古法療效低下,她設計的提取青蒿素的工藝可以簡化成如下流程:
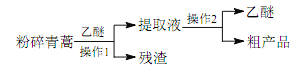
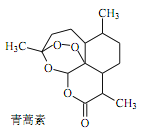
根據上述信息分析,下列判斷或敘述中肯定錯誤的是
A. 從天然植物中提取有效成分治療疾病是藥物研發的重要途徑
B. 將青蒿粉碎可以提高有效成分的提取率
C. 青蒿素易溶于水和乙醚
D. 操作 1 是過濾,操作 2 是蒸餾
科目:高中化學 來源: 題型:
【題目】下列化學用語正確的是( )
A. H2SO3的電離方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的電離方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學技術大學的錢逸泰教授等以CCl4和金屬鈉為原料,在700℃時反應制造出納米級金剛石粉末和另一種化合物。該成果發表在世界權威的《科學》雜志上,被科學家們高度評價為“稻草變黃金”。下列有關說法中,你認為錯誤的是( )
A. Na的還原性強于金剛石B. 另一種化合物是NaCl
C. 納米級金剛石粉末可以透過半透膜D. 這個反應是置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A. 2.3gNa投入到97.7g水中形成溶液的質量分數為2.3%
B. 25g CuSO4.5H2O溶于水配成1L溶液,溶質的物質的量濃度為0.1mol/L
C. Na2O2溶于水后溶質未發生改變
D. 標準狀況下,22.4 L的SO3中所含分子數為NA個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸銅可用于生產木材防腐劑等。工業上可用微蝕刻廢液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制備高純度堿式碳酸銅,其制備過程如下:

(1)試劑1最好選用_________。
a.Fe2O3 b.CaCO3 c.CuO
(2)加入Na2CO3沉淀前須除去Fe3+,否則Fe2(SO4)3會與Na2CO3反應,產生一種氣體,同時生成NaFe3(OH)6(SO4)2沉淀,影響產品質量,寫出該反應的化學方程式________________。
(3)加入Na2CO3沉淀時,反應液pH對產品中SO42-的含量以及反應液中Cu2+沉淀效率的影響如下圖所示,第二次沉淀時溶液pH最好控制在________。

(4)所制得的堿式碳酸銅的組成可表示為:xCuCO3·yCu(OH)2·zH2O,要測定其組成,甲同學設計的實驗方案中需要如下五個步驟:①稱取12.0克的樣品;②高溫分解;③測出生成CO2的質量為2.2克;④測出生成水蒸氣的質量為1.8克⑤稱量生成CuO的質量為8.0g。計算出堿式碳酸銅的組成,寫出計算過程。____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用圖所示裝置檢驗乙烯時不需要除雜的是

乙烯的制備 | 試劑X | 試劑Y | |
A | CH3CH2Br與NaOH乙醇溶液共熱 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br與NaOH乙醇溶液共熱 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH與濃H2SO4共熱至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH與濃H2SO4共熱至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用I2O5可消除CO污染,反應為I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同溫度下,向裝有足量的I2O5固體的2L恒容密閉容器中通入2mol CO,測得CO2 的體積分數ψ(CO2)隨時間t變化曲線如右圖,下列說法正確的是
5CO2(g)+I2(s)。不同溫度下,向裝有足量的I2O5固體的2L恒容密閉容器中通入2mol CO,測得CO2 的體積分數ψ(CO2)隨時間t變化曲線如右圖,下列說法正確的是

A. b點時,CO的轉化率為20%
B. 容器內的壓強保持恒定,表明反應達到平衡狀態
C. b點和d點的化學平衡常數:Kb>Kd
D. 0到0.5min反應速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某些廢舊塑料可采用下列方法處理:將廢塑料隔絕空氣加強熱,使其變成有用的物質,實驗裝置如下圖。加熱聚丙烯廢塑料得到的產物如下表:
產物 | 氫氣 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
沸點(℃) | -252.8 | -146 | -103.7 | -47.4 | 80.10 | 110.63 | 4827 |

(1)甲試管中最終殘留物是_____________。它有多種用途,如下列轉化就可制取聚乙炔。寫出反應②的化學方程式__________________________ 。
![]()
(2)乙中試管收集到的兩種產品中,有一種能使酸性高錳酸鉀溶液褪色的物質,該物質為__________。
(3)丙中錐形瓶觀察到的現象_____________________________________。反應的化學方程式是__________________________、_________________________。
(4)經溴的四氯化碳溶液充分吸收,最后收集到的氣體是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在3個體積均為1 L的恒容密閉容器中發生反應:SO2(g)+2NO(g)![]() 2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是
2NO2(g)+S(s)。改變容器I的反應溫度,平衡時c( NO2)與溫度的關系如下圖所示。下列說法正確的是


A. 該反應的ΔH<0
B. T1時,該反應的平衡常數為![]()
C. 容器Ⅰ與容器Ⅱ均在T1時達到平衡,總壓強之比小于1:2
D. 若T2<T1,達到平衡時,容器Ⅲ中NO的體積分數小于40%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com