
【題目】室溫下,向圓底燒瓶中加入1 molC2H5OH和含1molHBr的氫溴酸,溶液中發生反應;C2H5OH+HBr![]() C2H5Br+H2O,充分反應后達到平衡。已知常壓下,C2H5Br和C2H5OH的沸點分別為38.4℃和78.5℃。下列有關敘述錯誤的是
C2H5Br+H2O,充分反應后達到平衡。已知常壓下,C2H5Br和C2H5OH的沸點分別為38.4℃和78.5℃。下列有關敘述錯誤的是
A. 加入NaOH,可增大乙醇的物質的量
B. 增大HBr濃度,有利于生成C2H5Br
C. 若反應物增大至2 mol,則兩種反應物平衡轉化率之比不變
D. 若起始溫度提高至60℃,可縮短反應達到平衡的時間
【答案】D
【解析】分析:本題考查反應速率和平衡的基本知識。根據題目的反應,主要判斷外界條件的變化對平衡和速率的應該結果即可。
詳解:A.加入NaOH,中和HBr,平衡逆向移動,可增大乙醇的物質的量。選項A正確。
B.增大HBr濃度,平衡正向移動,有利于生成C2H5Br。選B正確。
C.若反應物增大至2 mol,實際上就是將反應的濃度都增大至原來的2倍,比例不變(兩次實驗反應物的比例都是1:1,等于方程式中的系數比),這里有一個可以直接使用的結論:只要反應物的投料比等于系數比,達平衡時反應物的轉化率一定是相等的。所以兩種反應物的轉化率一定是1:1。選項C正確。
D.若起始溫度提高至60℃,考慮到HBr是揮發性酸,在此溫度下會揮發出去,降低HBr的濃度減慢速率,增加了反應時間。選項D錯誤。


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案科目:高中化學 來源: 題型:
【題目】孔雀石主要含Cu2(OH)2CO3,還含少量Fe、Si的化合物。實驗室以孔雀石為原料制備CuSO4·5H2O及CaCO3,步驟如下:
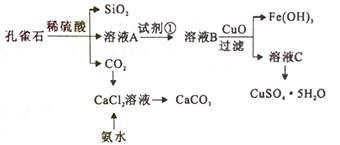
下列說法正確的是
A. 為將溶液A中的Fe2+氧化為Fe3+,試劑①可選用雙氧水、氯氣等
B. 流程中所加的CuO可以用Cu代替
C. 由溶液C獲得CuSO4·5H2O,需要經過蒸發濃縮、冷卻結晶、過濾、洗滌等操作
D. 制備CaCO3時,應向CaCl2溶液中先通入CO2,再加入氨水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近我國科學家設計了一種CO2+H2S協同轉化裝置,實現對天然氣中CO2和H2S的高效去除。示意圖如圖所示,其中電極分別為ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯電極區發生反應為:

①EDTA-Fe2+-e-=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
該裝置工作時,下列敘述錯誤的是
A. 陰極的電極反應:CO2+2H++2e-=CO+H2O
B. 協同轉化總反應:CO2+H2S=CO+H2O+S
C. 石墨烯上的電勢比ZnO@石墨烯上的低
D. 若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需為酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質:①固體燒堿 ②HCl氣體 ③SO3 ④CCl4⑤石墨 ⑥濃硫酸 ⑦液態醋酸 ⑧碳酸鈣 ⑨熔融KCl中,(填編號,下同)
屬于強電解質的是____________________,屬于非電解質的是__________________,能導電的是___________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Li是最輕的固體金屬,采用Li作為負極材料的電池具有小而輕、能量密度大等優良性能,得到廣泛應用。回答下列問題:
(1)下列Li原子電子排布圖表示的狀態中,能量最低和最高的分別為_____、_____(填標號)。
A.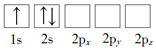 B.
B.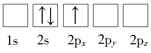
C.![]() D.
D.![]()
(2)Li+與H具有相同的電子構型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有機合成中常用的還原劑,LiAlH4中的陰離子空間構型是______、中心原子的雜化形式為______。LiAlH4中,存在_____(填標號)。
A.離子鍵 B.σ鍵 C.π鍵 D.氫鍵
(4)Li2O是離子晶體,其晶格能可通過圖(a)的BornHaber循環計算得到。
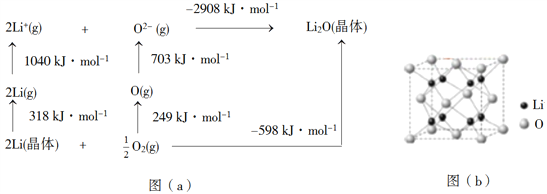
可知,Li原子的第一電離能為________kJ·mol1,O=O鍵鍵能為______kJ·mol1,Li2O晶格能為______kJ·mol1。
(5)Li2O具有反螢石結構,晶胞如圖(b)所示。已知晶胞參數為0.4665 nm,阿伏加德羅常數的值為NA,則Li2O的密度為______g·cm3(列出計算式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】AlPO4的沉淀溶解平衡曲線如圖所示(T2>T1).下列說法正確的是( )
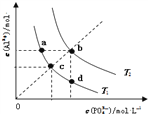
A. 圖象中四個點的Ksp:a=b>c>d
B. AlPO4在b點對應的溶解度大于c點
C. AlPO4(s)Al3+(aq)+PO43-(aq)△H<0
D. 升高溫度可使d點移動到b點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源、環境與生產生活和社會發展密切相關。
(1)一定溫度下,在兩個容積均為2L的密閉容器中,分別發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相關數據如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。相關數據如下:
容器 | 甲 | 乙 |
反應物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
平衡時c(CH3OH) | c1 | c2 |
平衡時能量變化 | 放出29.4kJ | 吸收akJ |
①下列情況能說明該反應一定達到平衡狀態的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成 b.氣體的密度不再隨時間改變
c.CO2和CH3OH的濃度之比不再隨時間改變 d.氣體的平均相對分子質量不再隨時間改變
②其他條件不變,達到平衡后,下列不能提高H2轉化率的操作是_________(填字母)。
a.降低溫度 b.充入更多的H2 c.移除甲醇 d.增大容器體積
③cl_________c2(填“>”、“<”或“=”),a=_________。
④該溫度下反應的平衡常數K=_________;若甲中反應10s時達到平衡,則0~10s內甲中的平均反應速率v(H2)=_________。
(2)已知反應:2NO2(紅棕色)![]() N2O4(無色)△H<0。將一定量的NO2充入注射器中后封口,如圖是在拉伸和壓縮注射器的過程中氣體透光率隨時間的變化(氣體顏色越深,透光率越小)。下列說法正確的是__________(填字母)。
N2O4(無色)△H<0。將一定量的NO2充入注射器中后封口,如圖是在拉伸和壓縮注射器的過程中氣體透光率隨時間的變化(氣體顏色越深,透光率越小)。下列說法正確的是__________(填字母)。
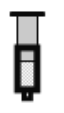
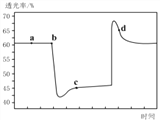
A.b點的操作是壓縮注射器
B.d點:v正>v逆
C.c點與a點相比,c(NO2)增大,c(N2O4)減小
D.若不忽略體系溫度變化,且沒有能量損失,則Tb>Tc
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把6.5gZn放入足量的鹽酸中,鋅完全反應。計算:
(1)6.5gZn的物質的量?
(2)參加反應的HCl的物質的量?
(3)生成氫氣的體積(標準狀況)?
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com