
【題目】pH=2的A、B兩種酸溶液各1mL,分別加水稀釋到1000mL,其中pH與溶液體積V的關系如圖所示.下列說法正確的是( )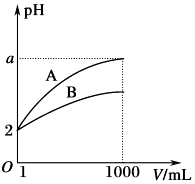
A.A,B兩酸溶液的物質的量濃度一定相等
B.稀釋后,A酸溶液的酸性比B酸溶液強
C.a=5時,A是強酸,B是弱酸
D.若a小于5,則A,B都是弱酸,且A的酸性弱于B
【答案】C
【解析】A.因A、B酸的強弱不同,一元強酸來說c(酸)=c(H+),對于一元弱酸,c(酸)>c(H+),則A、B兩種酸溶液的物質的量濃度不一定相等,A不符合題意;
B.若A、B都是強酸,則稀釋后溶液的pH都是5,與圖象曲線變化不相符,B不符合題意;
C.由圖可知,若a=5,A完全電離,則A是強酸,B的pH變化小,則B為弱酸,C符合題意;
D.稀釋1000倍,若a小于5,則A、B都是弱酸,且A的酸性強于B,D不符合題意;
故答案為:C
A.pH相同的強酸和弱酸,其溶質的物質的量不同;
B.稀釋后,溶液A的pH值大于溶液B的pH值,pH值越大,酸性越小;
C.稀釋會促進弱酸的電離,產生更多的氫離子,pH值變化較小;
D.酸性越多,電離程度越大;


 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:
【題目】研究發現,可以用石墨作陽極、鈦網作陰極、熔融的 CaF2﹣CaO 作電解質,利用如圖 所示裝置獲得金屬鈣,并以鈣為還原劑還原二氧化鈦制備金屬鈦.下列說法中,正確的是( ) 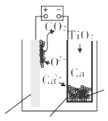
A.由 TiO2 制得 1 mol 金屬 Ti,理論上外電路通過 2 mol 電子
B.陽極的電極反應式為 C+2O2﹣﹣4e﹣═CO2↑
C.在制備金屬鈦前后,整套裝置中 CaO 的總量減少
D.若用鉛蓄電池作該裝置的供電電源,“+”接線柱應連接 Pb 電極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.95℃純水的pH<7,說明加熱可導致水呈酸性
B.向水中加入少量稀硫酸,c(H+)增大,KW不變
C.向水中加入氨水,水的電離平衡向正反應方向移動,c(OH﹣)增大
D.pH=3的醋酸溶液,稀釋至10倍后pH=4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C三種常見物質中均含有同一種元素,它們之間有如圖所示的轉化關系(部分反應物質已略去)。下列說法不正確的是

A. 若A是一種兩性氧化物,則B的水溶液可呈酸性,C的水溶液可呈堿性
B. 若A為一種金屬單質時,則反應①、②、③均可為化合反應,反應④可為置換反應
C. 若A、B、C是三種不同類別的固態物質,則B可以是工業上制取A、C的原料
D. 若A、B均是可燃性物質,完全燃燒都生成氣體C,常溫下A溶液pH<7,則將C通入A溶液中,pH值先減小后增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上一般在恒容密閉容器中采用下列反應合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判斷反應達到平衡狀態的依據是(填字母序號,下同) .
A.生成CH3OH的速率與消耗CO的速率相等
B.混合氣體的密度不變
C.混合氣體的相對平均分子質量不變
D.CH3OH、CO、H2的濃度都不再發生變化
E.氣體的壓強不再改變
(2)表所列數據是該反應在不同溫度下的化學平衡常數(K).
溫度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應后,達到平衡時測得c(CO)=0.2mol/L,則CO的轉化率為 , 此時的溫度為 .
(3)要提高CO的轉化率,可以采取的措施是 .
a.升溫 b.加入催化劑 c.增加CO的濃度 d.恒容下加入H2使壓強變大
e.恒容下加入惰性氣體使壓強變大 f.分離出甲醇
(4)在250℃時,測得某密閉容器中各物質的物質的量濃度見表:
CO | H2 | CH3OH |
0.5molL﹣1 | 2molL﹣1 | 6molL﹣1 |
此時反應的正、逆反應速率的關系是:v(正)v(逆)(填“>”“<”或“═”).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、D、E、F、G是原子序數依次增大的六種短周期元素。A和B能形成B2A和B2A2兩種化合物,B、D、G的最高價氧化物對應水化物兩兩之間都能反應,D、F、G原子最外層電子數之和等于15。回答下列問題:
(1)E元素在元素周期表中的位置是___________;A離子的結構示意圖為____________。
(2)D的單質與B的最高價氧化物對應水化物的溶液反應,其離子方程式為________。
(3)①B2A2中含有___________鍵和___________鍵。
②該物質與水反應的化學反應方程式為___________________。
(4)下列說法正確的是____________(填字母序號)。
①B、D、E原子半徑依次減小
②六種元素的最高正化合價均等于其原子的最外層電子數
③D的最高價氧化物對應水化物可以溶于氨水
④元素氣態氫化物的穩定性:F>A>G
(5)在E、F、G的最高價氧化物對應水化物中,酸性最強的為__________(填化學式),用原子結構解釋原因:同周期元素電子層數相同,從左至右,__________,得電子能力逐漸增強,元素非金屬性逐漸增強。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com