
【題目】反應2X(g)+Y(g)![]() 2Z(g)(正反應放熱),在不同溫度(T1和T2)及壓強(p1和p2)下,產物Z的物質的量(n)與反應時間(t)的關系如圖所示。
2Z(g)(正反應放熱),在不同溫度(T1和T2)及壓強(p1和p2)下,產物Z的物質的量(n)與反應時間(t)的關系如圖所示。
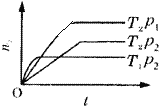
下述判斷正確的是( )
A.T1>T2,p1>p2B.T1<T2,p1>p2
C.T1<T2,p1<p2D.T1>T2,p1<p2
 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:
【題目】下表為元素周期表中第四周期的部分元素![]() 從左到右按原子序數遞增排列
從左到右按原子序數遞增排列![]() ,根據要求回答下列問題:
,根據要求回答下列問題:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基態原子的電子排布中,4s軌道上只有1個電子的元素有______![]() 填元素名稱
填元素名稱![]() 。
。
(2)以上元素中,屬于s區的元素有_________種,屬于d區的元素有______種。
(3)第一電離能![]() ________
________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”,下同
”,下同![]() 。
。
(4)現有含鈦的兩種顏色的晶體,![]() 的配位數均為6,一種為紫色,一種為綠色,相關實驗證明,兩種晶體的組成皆為
的配位數均為6,一種為紫色,一種為綠色,相關實驗證明,兩種晶體的組成皆為![]() 。為測定這兩種晶體的化學式,設計了如下實驗:
。為測定這兩種晶體的化學式,設計了如下實驗:
![]() 分別取等質量的兩種配合物晶體的樣品配成待測溶液;
分別取等質量的兩種配合物晶體的樣品配成待測溶液;
![]() 分別往待測溶液中滴入
分別往待測溶液中滴入![]() 溶液,均產生白色沉淀;
溶液,均產生白色沉淀;
![]() 溶液反應得到的白色沉淀質量為紫色晶體的水溶液反應得到沉淀質量的
溶液反應得到的白色沉淀質量為紫色晶體的水溶液反應得到沉淀質量的![]() 。試推斷紫色晶體的化學式為_________。
。試推斷紫色晶體的化學式為_________。
(5)含有元素K的鹽的焰色反應為__________色。許多金屬鹽都可以發生焰色反應,其原因是____________。
(6)立方氮化硼晶體![]() ,是一種超硬材料,有優異的耐磨性,其晶胞如圖所示。
,是一種超硬材料,有優異的耐磨性,其晶胞如圖所示。
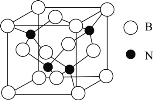
若立方氮化硼晶胞的邊長為![]() ,則立方氮化硼的密度為________g/cm3
,則立方氮化硼的密度為________g/cm3![]() 只要求列算式,不必計算出數值,阿伏加德羅常數的值為NA)。
只要求列算式,不必計算出數值,阿伏加德羅常數的值為NA)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是(NA表示阿伏加德羅常數的值)( )
A. 1mol甲基含10NA個電子
B. 15 g C2H6中含有共價鍵數目為3NA
C. 標準狀況下,11.2 L三氯甲烷所含的分子數目為0.5NA
D. 一定條件下,2.6 g苯和苯乙烯的混合物完全燃燒消耗O2的分子數為0.25NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用環己醇脫水的方法合成環己烯,該實驗的裝置如圖所示:
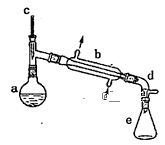
可能用到的有關數據如下:
相對分子質量 | 密度/(g·cm-3) | 沸點/℃ | 溶解性 | |
環已醇 | 100 | 0.9618 | 161 | 微溶于水 |
環已烯 | 82 | 0.8102 | 83 | 難溶于水 |
按下列實驗步驟回答問題:
Ⅰ.產物合成
在a中加入10.0g環己醇和2片碎瓷片,冷卻攪拌下慢慢加入1mL濃硫酸,b中通入冷卻水后,開始緩慢加熱a,控制餾出物的溫度接近90℃。
(l)碎瓷片的作用是__;
(2)a中發生主要反應的化學方程式為___;本實驗最容易產生的有機副產物的結構簡式為__。
Ⅱ.分離提純
將反應粗產物倒入分液漏斗中,依次用少量5%碳酸鈉溶液和水洗滌,分離后加入無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣,最終通過操作X得到純凈的環己烯,稱量,其質量為4.1g。
Ⅲ.產物分析及產率計算
(3)①核磁共振氫譜可以幫助鑒定產物是否為環己烯,環己烯分子中有___種不同化學環境的氫原子。
②本實驗所得環己烯的產率是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某芳香烴A,分子式為C8H10;某烴類衍生物X,分子式為C15H14O3,能使FeCl3溶液顯紫色;J分子內有兩個互為對位的取代基.在一定條件下有如下的轉化關系:(無機物略去)
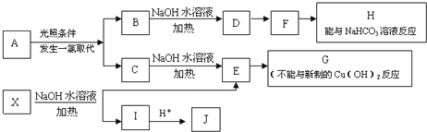
(1)屬于芳香烴類的A的同分異構體中,其沸點的大小關系為______;(不包括A,用結構簡式表示)
(2)J中所含的含氧官能團的名稱為______;
(3)E與H反應的化學方程式是________;反應類型是_______;
(4)B、C的混合物在NaOH乙醇溶液中加熱可以生成同一種有機物I,以I為單體合成的高分子化合物的名稱是______;
(5)已知J有多種同分異構體,寫出一種符合下列性質的J的同分異構體的結構簡式_______;
①與FeCl3溶液作用顯紫色
②與新制Cu(OH)2懸濁液作用產生紅色沉淀
③苯環上的一鹵代物有2種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將不同物質的量的M(g)和N(g)分別通入體積為2L的恒容密閉容器中,進行反應M(g)+N(g)![]() P(g)+Q(g),得到如下兩組數據:
P(g)+Q(g),得到如下兩組數據:

下列說法正確的是( )
A.將實驗2的體積壓縮為1L,c(Q)為0.4molL-1
B.溫度升高,該反應的平衡常數增大
C.選擇合適的催化劑可降低該反應的活化能,提高M的轉化率
D.實驗1中M的化學反應速率為0.32molL-1min-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,通過下列反應可實現燃煤煙氣中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) ΔH
2CO2(g)+S(l) ΔH
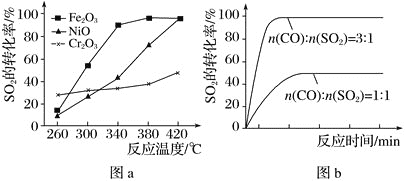
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJmol-1;S(l)+O2(g)=SO2(g) ΔH2=-296 kJmol-1,則反應熱ΔH=___kJmol-1。
(2)其他條件相同、催化劑不同時,SO2的轉化率隨反應溫度的變化如圖a所示。260℃時___(填“Fe2O3”、“NiO”或“Cr2O3”)作催化劑反應速率最快。Fe2O3和NiO作催化劑均能使SO2的轉化率達到最高,不考慮價格因素,選擇Fe2O3的主要優點是___。
(3)科研小組在380℃、Fe2O3作催化劑時,研究了不同投料比[n(CO):n(SO2)]對SO2轉化率的影響,結果如圖b所示。請分析當n(CO):n(SO2)=1:1時,SO2轉化率接近50%的原因___。
(4)工業上還可用Na2SO3溶液吸收煙氣中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某溫度下用1.0molL-1Na2SO3溶液吸收純凈的SO2,當溶液中c(SO32-)降至0.2molL-1時,吸收能力顯著下降,應更換吸收劑。此時溶液中c(HSO3-)約為___molL-1,溶液的pH=___。(已知該溫度下亞硫酸的平衡常數Ka1=1.75×10-2,Ka2=1.25×10-7)
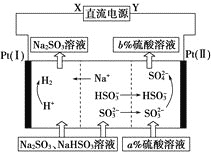
(5)用Na2SO3溶液吸收硫酸工業尾氣中的二氧化硫,將所得的混合液進行電解循環再生,這種新工藝叫再生循環脫硫法。其中陰、陽離子交換膜組合循環再生機理如圖所示。請寫出該電解過程中,陰極區發生反應的方程式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中,有機產物只有一種的是
A.乙醇與氧氣在銅催化下的氧化反應
B.丙烯(CH3CH=CH2)與HBr的加成反應
C.甲苯在一定條件下發生硝化生成一硝基甲苯的反應
D.異戊二烯(![]() )與等物質的量的Br2發生加成反應
)與等物質的量的Br2發生加成反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com