
【題目】用可再生的物質制備乙酸乙酯的綠色合成路線之一如圖所示:

⑴M的化學式為_______________________;
⑵反應③的反應類型為____________________;
⑶寫出反應④的化學方程式: _____________________________;
⑷寫出反應②的方程式: ______________________________。
【答案】C6H12O6 氧化反應 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O C6H12O6
CH3COOCH2CH3+H2O C6H12O6 ![]() 2 CH3CH2OH+2CO2↑
2 CH3CH2OH+2CO2↑
【解析】
淀粉或纖維素完全水解得到葡萄糖,葡萄糖經酒化酶的作用生成乙醇;乙醇可以被酸性高錳酸鉀氧化生成乙酸,乙酸和乙醇發生酯化反應生成乙酸乙酯。
(1)M為葡萄糖,化學式為C6H12O6;
(2)乙醇到乙酸,增加了氧原子減少了氫原子,所以為氧化反應;
(3)該反應為乙酸和乙醇的酯化反應,方程式為CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)反應②為葡萄糖在酶的作用下生成乙醇和二氧化碳,方程式為C6H12O6 ![]() 2 CH3CH2OH+2CO2↑。
2 CH3CH2OH+2CO2↑。


 百強名校期末沖刺100分系列答案
百強名校期末沖刺100分系列答案 好成績1加1期末沖刺100分系列答案
好成績1加1期末沖刺100分系列答案 金狀元績優好卷系列答案
金狀元績優好卷系列答案科目:高中化學 來源: 題型:
【題目】
釩及其化合物在科學研究中和工業生產中具有許多用途。
(1)基態釩原子的核外價電子排布式為________。
(2)釩有+2、+3、+4、+5等幾種化合價。這幾種價態中,最穩定的是______。
(3)V2O5溶解在NaOH溶液中,可得到釩酸鈉(Na3VO4)。例舉與VO43-空間構型相同的一種陽離子__________(填化學式)。
(4)釩(Ⅱ)的配離子有[V(CN)6]4-、[V(H2O)6]2+等。
①CN-與N2互為等電子體,CN-中σ鍵和Π鍵數目比為________。
②對H2O與V2+形成[V(H2O)6]2+過程的描述不合理的是______________。
a.氧原子的雜化類型發生了變化
b.微粒的化學性質發生了改變
c.微粒中氫氧鍵(H-O)的夾角發生了改變。
d.H2O與V2+之間通過范德華力相結合。
③在[V(H2O)6]2+中存在的化學鍵有___________。
a.金屬鍵 b.配位鍵 c. σ鍵 d.Π鍵 f. 氫鍵
(5)已知單質釩的晶胞如圖,則V原子的配位數是_______,假設晶胞的邊長為d nm,密度ρ g·cm-3,則釩的相對原子質量為_______________。(設阿伏伽德羅常數為NA)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應X(g)![]() 4Y(g)+Z(g),在200℃和T℃時,X 的物質的量濃度(單位:mol·L-1)隨時間變 化的有關實驗數據見下表:
4Y(g)+Z(g),在200℃和T℃時,X 的物質的量濃度(單位:mol·L-1)隨時間變 化的有關實驗數據見下表:
時間/min | 0 | 2 | 4 | 6 | 8 | 10 |
200/℃ | 0.80 | 0.55 | 0.35 | 0.20 | 0.15 | 0.15 |
T/℃ | 1.00 | 0.65 | 0.35 | 0.18 | 0.18 | 0.18 |
下列有關該反應的描述正確的是
A. 在200℃時,4min內用Y表示的化學反應速率為0.1125mol·L-1·min-1
B. T℃下,6min時反應剛好達到平衡狀態
C. 根據上表內 X 的濃度變化,可知濃度越大,反應速率越大
D. 從表中可以看出T <200
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用催化氧化反應將SO2轉化為SO3是工業上生產硫酸的關鍵步驟。
(1)T1℃時,在2L密閉容器中充入0.6molSO3,圖1表示SO3物質的量隨時間的變化曲線。

①平衡時,SO3的轉化率為______(保留一位小數);在T1℃下反應2SO2(g)+O2(g) ![]() 2SO3(g) 的平衡常數為____________;若其他條件不變,在8min時壓縮容器的體積至1L,則n(SO3)的變化曲線為_______(填字母)。
2SO3(g) 的平衡常數為____________;若其他條件不變,在8min時壓縮容器的體積至1L,則n(SO3)的變化曲線為_______(填字母)。
②下表為不同溫度(T)下反應2SO2(g)+O2(g) ![]() 2SO3(g) △H<0的化學平衡常數(K):
2SO3(g) △H<0的化學平衡常數(K):
T/℃ | T2 | T3 |
K | 20.5 | 4.68 |
由此推知,其他條件相同,在T1、T2、T3三種不同溫度下,反應從開始至達到平衡時所需要的時間最長的是 _____________。(填“T1”、“T2”或“T3”)
(2)在體系恒壓的條件下進行反應:2SO2(g)+O2(g) ![]() 2SO3(g),原料氣中SO2和O2的物質的量之比(k)不同時,SO2的平衡轉化率與溫度(t)的關系如圖2所示:圖中k1、k2、k3的大小順序為____________。
2SO3(g),原料氣中SO2和O2的物質的量之比(k)不同時,SO2的平衡轉化率與溫度(t)的關系如圖2所示:圖中k1、k2、k3的大小順序為____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下述實驗中均有紅棕色氣體產生,對比分析所得結論不正確的是( )
|
|
|
① | ② | ③ |
A. 由①中的紅棕色氣體,推斷產生的氣體一定是混合氣體
B. 紅棕色氣體不能表明②中木炭與濃硝酸產生了反應
C. 由③說明濃硝酸具有揮發性,生成的紅棕色氣體為還原產物
D. ③的氣體產物中檢測出CO2,由此說明木炭一定與濃硝酸發生了反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,向容積為2 L的密閉容器中通入兩種氣體發生化學反應,反應中各物質的物質的量變化如圖所示,對該反應的推斷合理的是( )
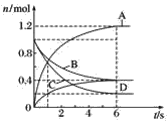
A.該反應的化學方程式為3B+4D![]() 6A+2C
6A+2C
B.反應進行到1 s時,v(A)=v(D)
C.反應進行到6 s時,B的平均反應速率為0.05 mol·L-1·s-1
D.反應進行到6 s時,各物質的反應速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列粒子![]() 分子或離子
分子或離子![]() 均含有18個電子:
均含有18個電子:
粒子 | A+ | B2- | C | D | E | F |
組成特點 | 單核離 | 化合物, 雙核分子 | 單質, 雙核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
下列說法錯誤的是
A.A的元素符號是K,B2-的離子結構示意圖是![]()
B.C的濃溶液可用于實驗室制Cl2
C.D的單質具有強氧化性,可將其同族元素的單質從鹽溶液中置換出來
D.F中可能既含極性鍵又含非極性鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈷鐵氧體(CoFe2O4)不僅是重要的磁性材料、磁致伸縮材料,還是重要的鋰離子電池負極材料。工業上,可以由廢舊鋰鈷電池正極材料(主要含Fe、Al、硅等雜質)回收鈷,再用電化學法制得CoFe2O4。其流程如圖所示(過程中所加試劑均足量)
Ⅰ.廢舊電池中鈷的回收

(1)含鋁濾液中,鋁元素的存在形式為________(寫化學式);硅在過程_____(填序號)與鈷分離。
(2)寫出過程②中LiCoO2與H2O2發生反應的化學方程式____________________________。
(3)過程③Na2CO3的主要作用為________________________________________。
Ⅱ.電解法制得鈷鐵合金
(4)配制 0.050molL-1 FeSO4和0.025molL-1 CoSO4的混合溶液,用銅作陰極、石墨作陽極進行電解,獲得CoFe2合金。陰極的電極方程式為____________________________________。
Ⅲ.陽極氧化法制得鈷鐵氧體
(5)以1.500molL1NaOH溶液作電解液,純凈的鈷鐵合金(CoFe2)作陽極進行電解,在陽極上獲得CoFe2O4薄膜。該電解過程的化學方程式為_________________________。
(6)當電路上有0.4mol電子轉移時,陽極電極材料增重質量為3.4g,與理論值不符,其原因可能為______________________________________________。
(7)由廢舊鋰鈷電池制CoFe2O4的現實意義在于:______________________(寫一條即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上乙醚可用于制造無煙火藥。無水乙醚微溶于水,熔點-116.3 ℃,沸點34.6 ℃,在空氣中遇熱易爆炸。實驗室合成乙醚的原理如下:
主反應:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反應:CH3CH2OH![]() H2C=CH2↑+H2O
H2C=CH2↑+H2O
(乙醚制備)裝置設計如圖所示(部分裝置略):
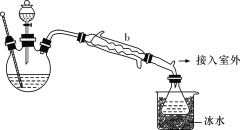
(1)儀器b應更換為下列中的________(填字母代號)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)實驗操作的正確排序為________(填字母代號),取出乙醚立即密閉保存。
a.安裝實驗儀器 b.加入12 mL濃硫酸和少量乙醇的混合物
c.檢查裝置氣密性 d.熄滅酒精燈
e.通冷卻水并加熱燒瓶 f.拆除裝置
g.控制滴加乙醇速率與餾出液速率相等
(3)反應溫度不超過145 ℃,其目的是____________________。
(乙醚提純)
![]()
(4)操作a的名稱是__________;進行該操作時,必須用水浴加熱代替酒精燈加熱,其目的與制備實驗中將尾接管支管通入室外相同,均為______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com