
【題目】一種微生物燃料電池的結構示意圖如下所示,關于該電池的敘述正確的是( )

A. 電池工作時,電子由a流向b
B. 微生物所在電極區放電時發生還原反應
C. 放電過程中,H+從正極區移向負極區
D. 正極反應式為:MnO2+4H++2e-===Mn2++2H2O
科目:高中化學 來源: 題型:
【題目】下圖所示是從鋁土礦(主要成分是Al2O3,含Fe2O3、SiO2等雜質)中提取氧化鋁的工藝流程之一。

回答下列問題:
(1)用鹽酸溶解鋁土礦后,所得溶液中的陽離子有_____________;
(2)固體A的主要成分是________;
(3)進行步驟Ⅱ時,為了達到分離要求,加入的NaOH應該_____(填少量或過量)。
(4)進行步驟Ⅲ時,一般通入過量CO2,其反應的離子方程式是________;
(5)溶液X和鹽酸反應的化學方程式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:① 2C(s)+O2(g)=2CO(g);ΔH= -220kJ·mol-1
② 氫氣燃燒的能量變化示意圖:
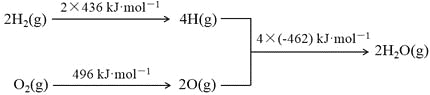
下列說法正確的是
A.1mol C(s)完全燃燒放出110 kJ的熱量
B.H2(g)+1/2O2(g)=H2O(g);ΔH= -480kJ·mol-1
C.C(s)+H2O(g)=CO(g)+H2(g);ΔH= +130kJ·mol-1
D.欲分解2mol H2O(l),至少需要提供4×462kJ的熱量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究大氣中含硫化合物(主要是SO2和H2S)的轉化具有重要意義。
(1)高濕條件下,寫出大氣中SO2轉化為HSO3-的方程式: 。
(2)土壤中的微生物可將大氣中H2S經兩步反應氧化成SO42-,兩步反應的能量變化示意圖如下:
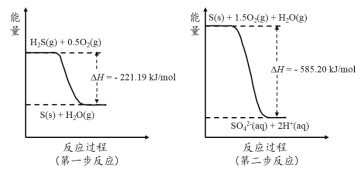
1mol H2S(g)全部氧化成SO42-(aq)的熱化學方程式為 。
(3)二氧化硫—空氣質子交換膜燃料電池可以利用大氣所含SO2快速啟動,其裝置示意圖如下:
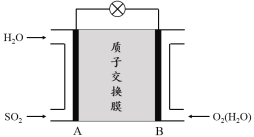
① 質子的流動方向為 (“從A到B”或“從B到A”)。
② 負極的電極反應式為 。
(4)燃煤煙氣的脫硫減排是減少大氣中含硫化合物污染的關鍵。SO2煙氣脫除的一種工業流程如下:
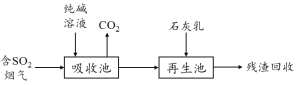
用純堿溶液吸收SO2將其轉化為HSO3-,反應的離子方程式是 。
若石灰乳過量,將其產物再排回吸收池,其中可用于吸收SO2的物質的化學式是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組設計了下列裝置,驗證二氧化碳跟過氧化鈉反應時需要與水接觸。

(1)裝置①中反應的化學反應方程式是__________________________。
(2)裝置②中的試劑是______(填序號)。
a.飽和Na2CO3溶液 b.飽和NaHCO3溶液 c.濃H2SO4
(3)裝置③中的試劑是______________。
進行實驗:
步驟1:打開彈簧夾K2,關閉K1,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在a處。
步驟2:打開彈簧夾K1,關閉K2,打開分液漏斗活塞加入鹽酸,將帶火星的木條放在a處。
(4)步驟1和步驟2中,a處帶火星的木條產生的實驗現象分別是__________。
(5)過氧化鈉跟二氧化碳反應的化學方程式是__________________________。
實驗反思:
(6)有同學提出質疑:“上述實驗不足以證明有水存在時過氧化鈉跟二氧化碳發生了化學反應。”其理由是__________________。(答案合理就得分,此空3分)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氧燃料電池是符合綠色化學理念的新型發電裝置。如圖為電池示意圖,該電池電極表面鍍一層細小的鉑粉,鉑吸附氣體的能力強,性質穩定,請回答:

(1)氫氧燃料電池能量轉化的主要形式是____________________________________________,在導線中電子流動方向為________(用a、b表示)。
(2)負極反應式為________________________________________________________________。
(3)該電池工作時,H2和O2連續由外部供給,電池可連續不斷提供電能,大量安全儲氫是關鍵技術之一。金屬鋰是一種重要的儲氫材料,吸氫和放氫原理如下:
Ⅰ.2Li+H2===2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反應Ⅰ中的還原劑是________,反應Ⅱ中的氧化劑是________。
②金屬鋰吸收的氫氣與放出的氫氣的物質的量之比為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3A(g)+B(g)═2C(g)在三種不同的條件下進行反應,在同一時間內,測得的反應速率用不同的物質表示為:①vA═1mol/(Lmin),②vC═0.5 mol/(Lmin),③vB═0.5 mol/(Lmin),三種情況下該反應速率大小的關系正確的是( )
A. ②>③>①B. ①>②>③C. ③>①>②D. ②>①>③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】德國化學家哈伯(F.Haber)從1902年開始研究由氮氣和氫氣直接合成氨。合成氨為解決世界的糧食問題作出了重要貢獻。其原理為N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol
(1)若已知H-H鍵的鍵能為436.0kJ/mol,N-H的鍵能為390.8kJ/mol,則N![]() N的鍵能約為_____kJ/mol
N的鍵能約為_____kJ/mol
(2)合成氨反應不加催化劑很難發生,催化劑鐵觸媒加入后參與了反應降低了活化能。其能量原理如圖所示,則加了催化劑后整個反應的速率由______決定(填“第一步反應”或者“第二步反應”),未使用催化劑時逆反應活化能______正反應活化能(填“大于”“小于”或者“等于”)
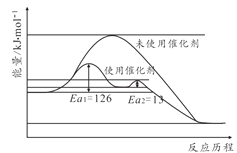
(3)從平衡和速率角度考慮,工業生產采取20MPa到50MPa的高壓合成氨原因______
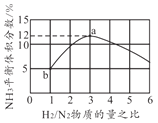
(4)一定溫度下恒容容器中,以不同的H2和N2物質的量之比加入,平衡時NH3體積分數如圖所示,則H2轉化率a點______b點(填"大于”“小于”或者“等于”)。若起始壓強為20MPa,則b點時體系的總壓強約為______MPa。
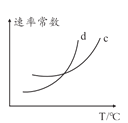
(5)若該反應的正逆反應速率分別表示為v正=K正![]() ,v逆=K逆c2(NH3),則一定溫度下,該反應 的平衡常數K=______(用含K正和K逆的表達式表示),若K正和K逆都是溫度的函數,且隨溫度升高而升高,則圖中c和d分別表示______和______隨溫度變化趨勢(填K正或者K逆)。
,v逆=K逆c2(NH3),則一定溫度下,該反應 的平衡常數K=______(用含K正和K逆的表達式表示),若K正和K逆都是溫度的函數,且隨溫度升高而升高,則圖中c和d分別表示______和______隨溫度變化趨勢(填K正或者K逆)。
(6)常溫下,向20mL的0.1mol/L的鹽酸中通入一定量氨氣反應后溶液呈中性(假設溶液體積變化忽略不計)則所得溶液中c(NH4+)=_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求填空
(1)1mol Na2O2固體與水完全反應時轉移的電子數_____________,反應的離子方程式為________________。
(2)工業上由輝銅礦生產銅的主要反應為:Cu2S+O2![]() 2Cu+SO2,該反應中被還原的元素是__________(填元素符號)。
2Cu+SO2,該反應中被還原的元素是__________(填元素符號)。
(3)反應(2)中產生的SO2尾氣可用NaOH溶液吸收,若用1L 1mol/L的NaOH溶液吸收標準狀況下22.4L SO2,反應的離子方程式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com