
【題目】能源問題是現代社會發展的三大基本問題之一。
(1)焦炭可用于制取水煤氣。實驗測得1.2 g 碳與水蒸氣完全反應生成水煤氣時,吸收了13.16 kJ熱量。該反應的熱化學方程式為_________________________;該反應在________條件下能自發進行(選“高溫”、“低溫”或“任意溫度”)。
(2)甲醇(CH3OH)廣泛用作燃料電池的燃料,工業上可由CO和H2來合成,化學方程式為CO(g)+2H2(g)![]() CH3OH(g)。如圖是在不同溫度下CO的轉化率隨時間變化的曲線。
CH3OH(g)。如圖是在不同溫度下CO的轉化率隨時間變化的曲線。
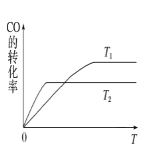
①T1________T2(填“>”、“<”或“=”)。T1和T2溫度下的平衡常數大小關系是K1________(填“>”、“<”或“=”)K2。
②若容器容積不變,下列措施不能增加CO轉化率的是________(填字母)。
a.降低溫度 b.將CH3OH(g)從體系中分離
c.使用合適的催化劑 d.充入He,使體系總壓強增大
③生成甲醇的化學反應速率(v)與時間(t)的關系如圖所示。則圖中t2時采取的措施可能是___________________;
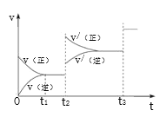
t3時采取的措施可能是 _________________。
④若在T1℃時,往一密閉容器通入等物質的量CO和H2測得容器內總壓強1MPa,40min達平衡時測得容器內總壓強為0.6MPa,計算生成甲醇的壓強平衡常數KP=________(MPa)-2(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。
(3)甲醇(CH3OH)燃料電池是以鉑為電極,以KOH溶液為電解質溶液,在兩極區分別加入CH3OH和O2即可產生電流。負極加入的物質是________;正極的電極反應為_______________________。
【答案】C(s)+H2O(g)=CO(g)+H2(g)△H =+131.6kJ·mol-1 高溫 < > cd 加壓 加入催化劑 66.7 CH3OH O2+4e-+2H2O =4OH—
【解析】
(1)1.2 g 碳為0.1mol,與水蒸氣完全反應生成水煤氣時,吸收了13.16 kJ熱量,反應的熱化學方程式為C(s)+H2O(g)=CO(g)+H2(g) △H =+131.6kJ·mol-1;該反應的正反應為吸熱反應,且氣體分子數增大的反應,自發進行△G=△H-T△S<0,該反應的△H>0,△S>0,所以高溫條件下才自發進行;故答案為:C(s)+H2O(g)=CO(g)+H2(g) △H =+131.6kJ·mol-1;高溫;
(2)①溫度越高,反應速率越快,由圖可知T1<T2,溫度高,一氧化碳的轉化率小,該反應的正反應為放熱反應,溫度升高,平衡逆向移動,平衡常數變小,所以K1>K2;故答案為:< ;>;
②a. 降低溫度,平衡正向移動,CO轉化率增大;不選a;
b. 將CH3OH(g)從體系中分離,平衡正向移動,CO轉化率增大;不選b;
c. 催化劑對平衡無影響,不能增加CO轉化率,選c;
d. 充入He,體系總壓強增大,各組分的濃度不變,平衡不移動,選d;故答案為:cd;
③CO(g)+2H2(g)![]() CH3OH(g)△H<0,由圖可知,t2時,改變外界環境,速率加快,平衡正向移動,所以加壓;t3時,改變外界環境,速率加快,平衡不移動,所以加入催化劑;故答案為:加壓;加入催化劑;
CH3OH(g)△H<0,由圖可知,t2時,改變外界環境,速率加快,平衡正向移動,所以加壓;t3時,改變外界環境,速率加快,平衡不移動,所以加入催化劑;故答案為:加壓;加入催化劑;
④設轉化的一氧化碳的物質的量為xmol,則:
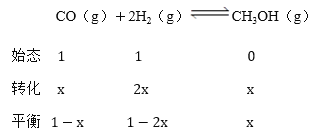
根據物質的量與壓強成正比關系,得到:![]() ,
,![]() ,x=0.4mol,則,
,x=0.4mol,則,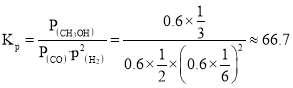 (MPa)-2;故答案為:66.7;
(MPa)-2;故答案為:66.7;
(3)燃料電池中,燃料作負極,發生氧化反應,失去電子;氧氣作正極,發生還原反應,得到電子,所以負極加入的物質為CH3OH,電解質溶液為堿,在堿性環境中,O2+4e-+2H2O =4OH-;故答案為:CH3OH;O2+4e-+2H2O =4OH-。


科目:高中化學 來源: 題型:
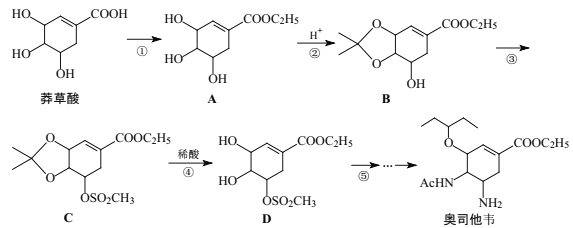
【題目】奧司他韋是一種高效、高選擇性神經氨酸酶抑制劑,可治療流感。以莽草酸作為起始原料合成奧司他韋的主流路線如圖:
已知: +H2O
+H2O
回答下列問題:
(1)下列關于莽草酸說法正確的有___。
A.莽草酸化學式是C7H8O5
B.與濃溴水反應可以生成白色沉淀
C.易溶于水和酒精
D.可以發生加成反應、消去反應、加聚反應、縮聚反應、取代反應
(2)奧司他韋中的官能團名稱為___(寫兩種)。
(3)反應①所需的試劑和條件為___。
反應②的化學方程式為___。
反應③的反應類型為___。
(4)芳香化合物X是B的同分異構體,測得其核磁共振氫譜有6組峰,其中兩組峰面積最大比值為9:1,則該物質的結構簡式是___。
(5)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳。C中有___個手性碳。
(6)參照上述合成路線,寫出由![]() 制備
制備![]() 的合成路線(其它試劑任選):___。
的合成路線(其它試劑任選):___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.1mol·L-1的KOH溶液滴定10mL0.1mol·L-1的H2C2O4溶液,所得滴定曲線如圖所示。忽略混合時溶液體積的變化,下列有關各點溶液中粒子濃度關系正確的是
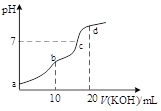
A.a點溶液中:c(H+)=0.1mol·L-1+c(OH-)-c(H2C2O4)+c(C2O42-)
B.b點溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.c點溶液中:c(K+)<c(C2O42-)-c(H2C2O4)+0.1mol·L-1
D.d點溶液中:c(OH-)-c(H+)=c(H2C2O4)+c(HC2O4-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組表述中,兩個原子不屬于同種元素原子的是( )
A.3p能級有一個空軌道的基態原子和核外電子的排布式為1s22s22p63s23p2的原子
B.2p能級無空軌道,且有一個未成對電子的基態原子和原子的最外層電子排布式為2s22p5的原子
C.M層全充滿而N層為4s2的原子和核外電子排布式為1s22s22p63s23p64s2的原子
D.最外層電子數是核外電子總數1/5的原子和最外層電子排布式為4s24p5的原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究表明,大氣中氮氧化物和碳氫化合物受紫外線作用可產生二次污染物——光化學煙霧,其中某些反應過程如圖所示。下列說法不正確的是

A. 整個過程中O3作催化劑
B. 反應III的方程式為O2+O===O3
C. 光化學煙霧中含甲醛、乙醛等刺激性物質
D. 反應I、反應Ⅱ均屬于氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L的密閉容器中充入2 molX(g)和1 mol Y(g),發生反應2X(g) +Y(g) ![]() 3Z(g) △H,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示,下列推斷正確的是
3Z(g) △H,反應過程中持續升高溫度,測得混合體系中X的體積分數與溫度的關系如圖所示,下列推斷正確的是

A.升高溫度.平衡常數增大
B.W點Y的正反應速率等于M點Y的正反應速率
C.Q點時,Y的轉化率最大
D.平衡時充入3molZ,達到新平衡時Z的體積分數比原平衡時大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥物瑞德西韋對新型冠狀病毒(COVID-19)有明顯抑制作用。K是合成瑞德西韋的關鍵中間體,其合成路線如下:
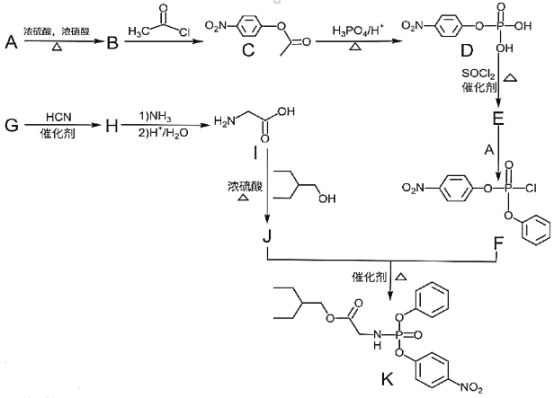
①R-OH![]() R-Cl;
R-Cl;
②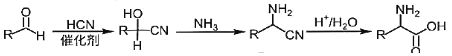
回答下列問題:
(1)B的結構簡式為_________________________,B→C的反應類型為_____________,J中含氧官能團的名稱為_______________,G→H的反應化學方程式為_____________________________________________。
(2)寫出符合下列條件的C的同分異構體X__________________________(填結構簡式,不考慮立體異構)。
①苯環上含有硝基且苯環上只有一種氫原子; ②與FeCl3溶液發生顯色反應; ③1molX與足量金屬Na反應可生成2g H2 。
(3)E中含兩個Cl原子,則E的結構簡式為________________________________________________。
(4)寫出以苯甲醇為原料制備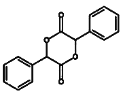 的合成路線(其它試劑任選):________________。
的合成路線(其它試劑任選):________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】粗銅精煉后的陽極泥中含有Cu、Au(金)和PbSO4等雜質,濕法處理陽極泥進行綜合利用的工藝流程如圖所示:
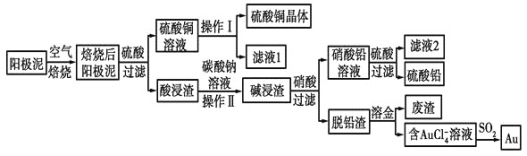
(1)電解精煉含銅、金、鉛的粗銅時,電解液應該用________溶液作電解液,電解時陽極的電極反應式為___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步驟有:__________________,過濾,洗滌,干燥。
(3)寫出用SO2還原AuCl4-的離子反應方程式____________________________。
(4)為了減少廢液排放、充分利用有用資源,工業上將濾液1并入硫酸銅溶液進行循環操作,請指出流程圖中另一處類似的做法________________________。
(5)用離子方程式表示加入碳酸鈉溶液的作用:___________________________。[已知298K時,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。當溶液中c(SO42-)=0.2mol/L時,c(CO32-)=________mol/L。![]() 結果保留2位有效數字
結果保留2位有效數字![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鉬(Mo)常用于工業、軍事等領域,已被多個國家列為戰略金屬,我國的鉬儲量居世界第二。回答下列問題
(1)Mo與Cr是同族元素,并且位于相鄰周期,寫出基態Mo原子的價電子的軌道表達式為_____________。
(2)輝鉬(MoS2)在納米電子設備制造領域比硅或富勒烯(如C60)更有優勢,可用H2S硫化(NH4)2MoO4溶液生產輝鉬。H2S分子VSEPR模型為____________,(NH4)2MoO4中所有元素的第一電離能由大到小的順序為________________;MoS2納米粒子具有類似于石墨的層狀結構,具有優異的潤滑性能,其原因是___________________________。
(3)碳酸鈉作固硫劑并用氫還原輝鉬礦的原理為MoS2+4H2+2Na2CO3![]() Mo+2CO+4H2O+2Na2S,分子或離子中的大π鍵可用符號
Mo+2CO+4H2O+2Na2S,分子或離子中的大π鍵可用符號![]() 表示,其中m代表參與形成的大π鍵原子數,n代表參與形成的大π鍵電子數(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成的大π鍵原子數,n代表參與形成的大π鍵電子數(如苯分子中的大π鍵可表示為![]() ),則碳酸鈉中CO32-離子中的大π鍵應表示為________。
),則碳酸鈉中CO32-離子中的大π鍵應表示為________。
(4)鉬的一種配合物化學式為:Na3[Mo(CN)8]8H2O,其中除共價鍵、配位鍵以外還存在的作用力有_____________,其中配體離子中σ鍵與π鍵數目之比為_________。
(5)金屬鉬晶體中的原子堆積方式如圖所示,這種堆積方式為_________堆積。若晶體鉬的密度為ρg·cm-3,鉬原子半徑為r pm,NA表示阿伏加德羅常數的值,M表示鉬的相對原子質量,則鉬晶胞中原子的空間利用率為__________________(用含有ρ、r、NA、M的代數式表示)。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com