
【題目】在下列物質分類中,前者包含后者的是( )
A.氧化物、化合物
B.化合物、電解質
C.溶液、膠體
D.溶液、分散系
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值。下列說法正確的是
A. 2.0gH218O與D2O的混合物中所含中子數為NA
B. 50mL18mol·L-1濃硫酸與足量銅供熱,轉移電子數為0.9NA
C. 0.1molCl2通入含0.1molFeBr2溶液中,被氧化的溴離子數為0.2NA
D. 標準狀況下,2.24LNO和足量O2反應生成物中含有NO2分子數為0.1NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醚(CH3OCH3)被稱為21世紀的新型燃料,它清潔、高效、具有優良的環保性能,甲醚是一種無色氣體,具有輕微的醚香味,其燃燒熱為1455 kJ·mol-1,甲醚可作燃料電池的燃料。
(1) 寫出甲醚燃燒的熱化學方程式___________________ ;已知H2(g)和C(s)的燃燒熱分別是285.8 kJ·mol-1、393.5 kJ·mol-1;計算反應:4C(s)+ 6H2(g)+ O2(g) = 2CH3OCH3(g)的反應熱為___________
(2) 工業上利用H2和CO2合成二甲醚的反應如下:6H2(g)+2CO2(g)![]() CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定溫度下,在一個固定體積的密閉容器中進行該反應。下列能判斷反應達到化學平衡狀態的是___________(選填編號,注意大小寫)
a.c(H2)與c(H2O)的比值保持不變
b.單位時間內有2mol H2消耗時,有1mol H2O生成
c.容器中氣體密度不再改變
d.容器中氣體壓強不再改變
②溫度升高,該化學平衡移動后,達到新的平衡,CH3OCH3的產率將________(填“變大”、“變小”或“不變”)
(3) 以甲醚、空氣、氫氧化鉀溶液為原料,石墨為電極可構成燃料電池。該電池的負極反應式的其中一個產物是CO32-,請寫出該反應的負極反應式___ _ ;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表各組物質中,物質之間不可能實現如圖![]() 所示轉化的是( )
所示轉化的是( )
選項 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | S(s) | SO2 | SO3 | O2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用A+、B-、C2-、D、E、F、G和H分別表示含有18個電子的八種微粒(離子或分子),請回答:
(1)A元素是________,B元素是___________,C元素是__________(用元素符號表示)。
(2)D是由兩種元素組成的雙原子分子,其結構式是__________________。
(3)E是所有含18個電子的微粒中氧化能力最強的分子,其分子式是________________。
(4)F是由兩種元素組成的三原子分子______,其電子式是________________。
(5)G分子中含有4個原子,它易溶于水的原因是________________
(6)A+與C2-形成的化合物水溶液呈_____性,其原因是(用離子方程式表示)___________,該水溶液中離子濃度由大到小的順序是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列判斷正確的是( )
A.沸點:CH4>NH3>H2O
B.得電子能力:C>N>O
C.酸性:H2SO4>HClO4>H3PO4
D.堿性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在工業上有許多用途。回答下列有關問題:
(1) FeCl3可用于金屬蝕刻、污水處理等。工業生產中FeCl3可由NaClO3氧化酸性FeCl2廢液(含有的溶質為FeCl2、FeCl3、HCl)制備。
①寫出NaClO3氧化酸性FeCl2廢液的離子方程式:_______________。
②測得pH=2的FeCl2廢液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,則c(Fe2+)=____mol· L-1,若在FeCl3的某次生產中處理了1m3該FeCl2廢液,則反應中轉移的電子為_________mol。
(2)鐵系氧化物材料在五金器材的拋光、光學儀器和玉石的磨光材料、吸波材料、半導體材料等方面得以廣泛應用。在空氣中加熱FeCO3可制得鐵系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
則在空氣中加熱FeCO3生成鐵系氧化物Fe2O3的熱化學方程式為_____________。
(3)已知在某種含鐵催化劑作用下發生下列反應;CO(g)+3H2(g) ![]() CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定溫度下和壓強條件下,把1molCO和3molH2加入到壓強為P0的恒壓密閉容器中,測得不同時間CO的體積分數![]() (CO)如下表:
(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①當______不再發生變化時(寫出一條即可),則表明CO(g)+3H2(g) ![]() CH4(g)+ H2O (g)達到平衡。
CH4(g)+ H2O (g)達到平衡。
②達到平衡時CO的轉化率為________;若用平衡分壓代替平衡濃度,則該溫度下的平衡常數K=____(已知:氣體分壓=氣體總壓×體積分數)。
③若下圖中表示該反應中CO的平衡轉化率與溫度、壓強的關系。圖中溫度T1、T2、T3由高到低的順序是______________。
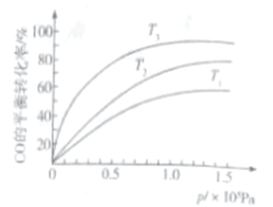
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵元素在地殼中的含量豐富。關于鐵及其化合物的說法錯誤的是
A. 鋼屬于鐵合金 B. Fe2O3常用作紅色油漆的原料
C. Fe(OH)3易溶于水 D. Fe3O4是具有磁性的黑色晶體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com