
【題目】下列中心原子的雜化軌道類型和分子幾何構型不正確的是
A. CCl4中C原子sp3雜化,為正四面體形
B. H2S分子中,S為sp2雜化,為直線形
C. CS2中C原子sp雜化,為直線形
D. BF3中B原子sp2雜化,為平面三角形
 開心試卷期末沖刺100分系列答案
開心試卷期末沖刺100分系列答案 雙基同步導航訓練系列答案
雙基同步導航訓練系列答案 黃岡小狀元同步計算天天練系列答案
黃岡小狀元同步計算天天練系列答案科目:高中化學 來源: 題型:
【題目】應對霧霾污染、改善空氣質量需要從多方面入手,如開發利用清潔能源。甲醇是一種可再生的清潔能源,具有廣闊的開發和應用前景。回答下列問題:
(1)CO2與H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。但是找到合適的催化劑是制約該方法的瓶頸。目前主要使用貴金屬催化劑,但是貴金屬儲量稀少,成本高昂,難以大規模應用,且使用中存在環境污染的風險。最近采用真空封管法制備磷化硼納米顆粒,在發展非金屬催化劑實現CO2電催化還原制備甲醇方向取得重要進展,該反應歷程如圖所示。
CH3OH(g)+H2O(g)。但是找到合適的催化劑是制約該方法的瓶頸。目前主要使用貴金屬催化劑,但是貴金屬儲量稀少,成本高昂,難以大規模應用,且使用中存在環境污染的風險。最近采用真空封管法制備磷化硼納米顆粒,在發展非金屬催化劑實現CO2電催化還原制備甲醇方向取得重要進展,該反應歷程如圖所示。
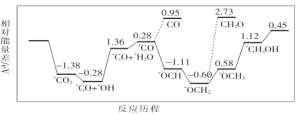
容易得到的副產物有CO和CH2O,其中相對較多的副產物為__;上述合成甲醇的反應速率較慢,要使反應速率加快,主要降低下列變化中__(填字母)的能量變化。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(2)恒壓(容器的容積可變)下,0.2molCO2與0.6molH2在催化劑作用下發生反應CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,CO2的平衡轉化率與溫度、壓強的關系如圖所示。
CH3OH(g)+H2O(g) △H,CO2的平衡轉化率與溫度、壓強的關系如圖所示。
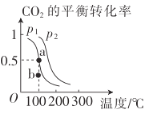
壓強p1__(填“<”或“>”)p2。
②在p1、100℃條件下,b點時v正__(填“<"或“>”)v逆。
③已知:反應速率v=v正-v逆=k正![]() ,k正、k逆分別為正、逆反應速率常數,x為物質的量分數,若b點對應的坐標參數為(100,0.4),計算b處的
,k正、k逆分別為正、逆反應速率常數,x為物質的量分數,若b點對應的坐標參數為(100,0.4),計算b處的![]() =__(保留3位有效數字)。
=__(保留3位有效數字)。
(3)焦炭與水蒸氣在恒容密閉容器中反應制合成氣的主要反應(Ⅰ)、(Ⅱ)的lgKP(KP為以分壓表示的平衡常數)與T的關系如圖所示。
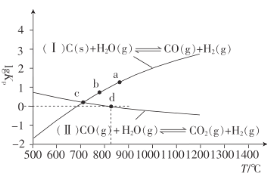
反應(Ⅱ)的△H__(填“大于”“等于”或“小于”)0。
②c點時,反應C(s)+CO2(g)![]() 2CO(g)的KP=__(填數值)。
2CO(g)的KP=__(填數值)。
③在恒容密閉容器中充入0.5molCO、2molH2O(g)只發生反應(Ⅱ),圖中d點處達到平衡時,CO的轉化率為__;達到平衡時,向容器中再充入0.5molCO、2molH2O(g),重新達到平衡時,CO的平衡轉化率__(填“增大”“減小”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年2月《Nature》報道的一種四室(1#~4#)自供電從低濃度廢水中回收銅等重金屬的裝置如下圖所示:
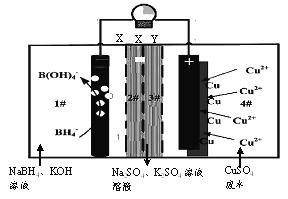
下列說法正確的是
A. 裝置工作時,4#室中溶液pH不變
B. X、Y依次為陰離子、陽離子選擇性交換膜
C. 負極的電極反應為:BH4-+8OH--8e-=B(OH)4-+4H2O
D. 單位時間內4n(NaBH4)消耗>n(Cu)生成是由于負極上有O2析出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素周期表是科學界最重要的成就之一。作為一種獨特的工具,它使科學家能夠預測地球上和宇宙中物質的外觀、性質及結構等。
(1)通常制造的農藥含元素F、P、S、Cl。四種元素的電負性從大到小的順序為_______;第一電離能從大到小的順序為_________。
(2)科學家曾利用元素周期表尋找F、Cl的含碳化合物作為制冷劑。已知CCl4的沸點為76.8℃,CF4的沸點為-128℃,若要求制冷劑沸點介于兩者之間,則含一個碳原子的該制冷劑可以是__________(寫出其中一種的化學式)。
(3)1963年以來科學家借助射電望遠鏡,在星際空間已發現NH3、HC≡C-C≡N等近兩百種星際分子。與NH3互為等電子體的陽離子為____;HC≡C-C≡N分子中![]() 鍵與
鍵與![]() 鍵的數目比n(
鍵的數目比n(![]() )∶n(
)∶n(![]() )=__________。
)=__________。
(4)過渡元素(包括稀土元素)中可尋找各種優良催化劑。Sc的一種氫化物的晶胞結構如圖所示,該氫化物的化學式為_________。
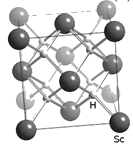
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是金屬鎂和鹵素單質(X2)反應的能量變化示意圖。下列說法正確的是
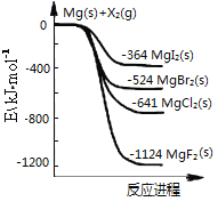
A. 鹵素單質(X2)與水反應均可生成兩種酸
B. MgF2的電子式為:![]()
C. 熱穩定性:MgI2>MgBr2>MgCl2>MgF2
D. 由圖可知此溫度下MgI2(s)與Cl2(g)反應的熱化學方程式為:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g) ΔH=-277 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.鐵與氯化鐵溶液反應:Fe+Fe3+=2Fe2+
B.氯化鋁溶液與過量的氫氧化鈉溶液反應:Al3++3OH-=Al(OH)3↓
C.氯氣與氫氧化鈉溶液反應:Cl2+2OH-=Cl-+ClO-+H2O
D.碳酸氫鈉溶液與稀鹽酸反應:2H++CO32-=CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在一定體積的密閉容器中進行可逆反應N2(g)+3H2(g)![]() 2NH3(g),下列說法中,能說明該反應已經達到化學平衡狀態的是( )
2NH3(g),下列說法中,能說明該反應已經達到化學平衡狀態的是( )
A.容器中N2、H2和NH3三種物質共存
B.容器中N2和H2的分子數之比為1:3
C.容器中N2、H2、NH3的濃度相等
D.NH3的生成速率和分解速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為驗證鹵素單質氧化性的相對強弱,某小組用如圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)。
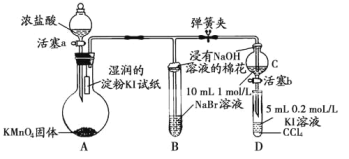
實驗過程:
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ.當B和C中的溶液都變為黃色時,夾緊彈簧夾。
Ⅲ.當B中溶液由黃色變為紅棕色時,關閉活塞a。
Ⅳ.……
(1)A中產生黃綠色氣體,其電子式是_____。
(2)驗證氯氣的氧化性強于碘的實驗現象是____。
(3)B中溶液發生反應的離子方程式是______。
(4)為驗證溴的氧化性強于碘,過程Ⅳ的操作和現象是_____。
(5)過程Ⅲ實驗的目的是______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
鉀和碘的相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)元素K的焰色反應呈紫紅色,其中紫色對應的輻射波長為_______nm(填標號)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基態K原子中,核外電子占據的最高能層的符號是_________,占據該能層電子的電子云輪廓圖形狀為___________。K和Cr屬于同一周期,且核外最外層電子構型相同,但金屬K的熔點、沸點等都比金屬Cr低,原因是___________________________。
(3)X射線衍射測定等發現,I3AsF6中存在I3+離子。I3+離子的幾何構型為_____________,中心原子的雜化形式為________________。
(4)KIO3晶體是一種性能良好的非線性光學材料,具有鈣鈦礦型的立體結構,邊長為a=0.446nm,晶胞中K、I、O分別處于頂角、體心、面心位置,如圖所示。K與O間的最短距離為______nm,與K緊鄰的O個數為__________。
(5)在KIO3晶胞結構的另一種表示中,I處于各頂角位置,則K處于______位置,O處于______位置。
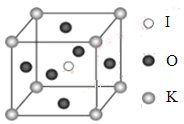
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com