
【題目】下列反應的離子方程式正確的是( )
A. 碳酸鈣跟醋酸反應:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸鋁溶液中加過量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亞鐵溶液中通入少量的氯氣:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氫鈉溶液與足量的氫氧化鋇溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、Z在周期表中位置關系如圖所示。
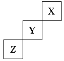
(1)X元素的單質分子式是___。若X核內中子數與質子數相等,X單質的摩爾質量是___。
(2)Y單質的電子式是___。
Y單質與水反應的化學方程式:___。
Z與鈉形成的化合物的電子式是:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學在我們的生產生活中占有越來越重要的地位。
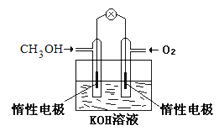
(1)①燃料電池是一種綠色環保、高效的化學電源。上圖為甲醇燃料電池,則負極反應式為____。
②用甲醇燃料電池電解300mL飽和食鹽水,則電解的化學方程式為_________。電解一段時間后,當溶液的pH值為13時,消耗O2的質量為______g。(忽略溶液體積變化,不考慮損耗)
③用甲醇燃料電池電解2L,1mol/L硫酸銅溶液,一段時間后:兩極共收集到標準狀況下的氣體89.6L,則電路中共轉移_______mol電子。
(2)利用電化學原理,將NO2、O2和熔融KNO3制成燃料電池,模擬工業電解法來處理含Cr2O72-廢水,如下圖所示;電解過程中溶液發生反應:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
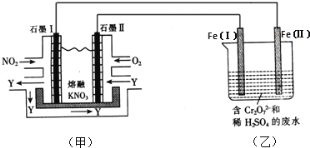
①甲池工作時,NO2轉變成綠色硝化劑Y,Y是N2O5,可循環使用,則石墨Ⅱ附近發生的電極反應式為__。
②向完全還原為Cr3+的乙池工業廢水中滴加NaOH溶液,可將鉻以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常溫下Cr(OH)3的溶度積Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH應調至________。
Cr3+(aq)+3OH-(aq),常溫下Cr(OH)3的溶度積Ksp=c(Cr3+)c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5molL-1,溶液的pH應調至________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮氧化物具有不同程度的毒性,利用構成電池方法既能實現有效消除氮氧化物的排放,減輕環境污染,又能充分利用化學能,發生反應 6NO2+ 8NH3= 7N2+12H2O,裝置如圖所示。下列關于該電池的說法正確的是

A. 為使電池持續放電,離子交換膜需選用陰離子交換膜
B. 電子從右側電極經過負載后流向左側電極
C. 電極A極反應式為2NH3 - 6e-=N2 +6H+
D. 當有4.48LNO2被處理時,轉移電子物質的量為 0.8mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制備丙烯的方法有多種,具體如下(本題丙烯用C3H6表示):
(1)丙烷(C3H8)脫氫制備丙烯(C3H6)
由下圖可得,C3H8(g)![]() C3H6(g)+H2(g),△H=_________kJ/.mol
C3H6(g)+H2(g),△H=_________kJ/.mol

(2)用惰性電極電解CO2的酸性溶液可得丙烯(C3H6),其原理如下圖所示。則b的電極反應式為__________。

(3)以丁烯(C4H8)和乙烯(C2H4)為原料反應生成丙烯(C3H6)的方法被稱為“烯歧化法”,反應為:C4H8(g)+C2H4(g)![]() 2C3H6(g) △H>0
2C3H6(g) △H>0
一定溫度下,在一體積恒為VL的密閉容器中充入一定量的C4H8和C2H4,發生烯烴歧化反應。
I.該反應達到平衡的標志是______________
a.反應速率滿足:2v生成(C4H8)=v生成(C3H6)
b.C4H8、C2H4、C3H6的物質的量之比為1:1:2
c.混合氣體的平均相對分子質量不再改變
d.C4H8、C2H4、C3H6的濃度均不再變化
Ⅱ.已知t1min時達到平衡狀態,測得此時容器中n(C4H8)=mmol,n(C2H4)=2mmol,n(C3H6)=nmol,且平衡時C3H6的體積分數為![]() 。
。
①該時間段內的反應速率v(C4H8)= _______mol/(L·min)。(用只含m、V、t1的式子表示)。
②此反應的平衡常數K=______________。
③t1min時再往容器內通入等物質的量的C4H8和C2H4,在新平衡中C3H6的體積分數_______![]() (填“>”“<”“=”)。
(填“>”“<”“=”)。
(4)“丁烯裂解法”是另一種生產丙烯的方法,但生產過程中伴有生成乙烯的副反應發生,具體反應如下:主反應:3C4H8![]() 4C3H6;副反應:C4H8
4C3H6;副反應:C4H8![]() 2C2H4
2C2H4
①從產物的純度考慮,丙烯和乙烯的質量比越高越好。則從下表現的趨勢來看,下列反應條件最適宜的是__________(填字母序號)。
a.300℃0.1MPa b.700℃0.1MPa c.300℃0.5MPa d.700℃0.5MPa
②下圖中,平衡體系中丙烯的百分含量隨壓強增大呈上升趨勢,從平衡角度解釋其可能的原因是_____。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素X形成的氣態X2的分子共有三種,其相對分子質量依次為158、160、162,此三種分子的物質的量之比為9:6:1,據此,下列說法中正確的是( )
A.X有三種同位素
B.其中一種同位素的質量數為80
C.X2的平均相對分子質量為159
D.質量數為79的同位素的原子百分數為50%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業生產硫酸時,其中之一的反應是2SO2+O2![]() 2SO3,下列說法錯誤的是
2SO3,下列說法錯誤的是
A. 使用催化劑能顯著增大反應速率
B. 壓縮體積可提高反應速率
C. 達到化學平衡時,反應停止
D. 增大SO2的濃度可提高反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量銅溶于一定量濃硝酸,產生NO2、N2O4、NO的混合氣體,這些氣體若與1.12 L O2(標準狀況)混合后通入水中,氣體被水完全吸收。若向原所得溶液中加入5 mol·L-1 H2SO4溶液100 mL,則繼續溶解的Cu的質量為( )
A. 6.4 g B. 9.6 g C. 19.2 g D. 24 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知H2(g) + I2(g) ![]() 2HI(g) △H < 0,有相同容積的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同溫度下分別達到平衡。下列說法不正確的是( )
2HI(g) △H < 0,有相同容積的密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入0.1mol H2和0.2mol I2,相同溫度下分別達到平衡。下列說法不正確的是( )
A. 乙中反應速率比甲中反應速率快
B. 平衡時甲、乙兩容器中混合物的總物質的量之比為2:3
C. 若平衡時甲中H2的轉化率為40%,則乙中H2的轉化率大于40%
D. 平衡后,向乙中再加入0.1mol H2,建立新的平衡時,甲和乙中H2的百分含量不相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com