
【題目】NA是阿伏加德羅常數的值。下列說法正確的是
A.26gC2H2與C6H6混合氣體中含σ鍵的數目為3NA
B.16.25gFeCl3水解形成的Fe(OH)3膠體粒子數為0.1NA
C.電解精煉銅時,當電路中轉移NA個電子,陰極析出32 g銅
D.標準狀況下11.2 LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒數之和為NA
【答案】C
【解析】
A.若26g全為C2H2,26gC2H2的物質的量為![]() ,26gC2H2中含有3molσ鍵,若26g全為C6H6,26gC6H6的物質的量為
,26gC2H2中含有3molσ鍵,若26g全為C6H6,26gC6H6的物質的量為![]() ,1mol C6H6中含有12molσ鍵,則26gC6H6含有4molσ鍵,因此26gC2H2與C6H6混合氣體中含σ鍵的數目為3NA-4NA,A選項錯誤;
,1mol C6H6中含有12molσ鍵,則26gC6H6含有4molσ鍵,因此26gC2H2與C6H6混合氣體中含σ鍵的數目為3NA-4NA,A選項錯誤;
B.16.25gFeCl3的物質的量為![]() ,水解得到0.1mol Fe(OH)3膠體,但Fe(OH)3膠體膠粒是由許多Fe(OH)3等小分子聚集而成,微粒數目小于0.1NA,B選項錯誤;
,水解得到0.1mol Fe(OH)3膠體,但Fe(OH)3膠體膠粒是由許多Fe(OH)3等小分子聚集而成,微粒數目小于0.1NA,B選項錯誤;
C.電解精煉銅時,陰極銅離子放電,發生的電極反應為Cu2++2e-===Cu,當電路中轉移NA個電子,有0.5molCu生成,其質量為0.5mol×64g·mol-1=32g,C選項正確;
D.標準狀況下,11.2L Cl2的物質的量是0.5mol,Cl2溶于水,與水的反應是可逆反應,不能完全轉化為生成物,所以溶液中Cl-、ClO-和HClO的微粒數之和小于NA,D選項錯誤;
答案選C。


科目:高中化學 來源: 題型:
【題目】在標準狀況下,7.84L甲烷完全燃燒后生成二氧化碳和液態水,同時放出311.4kJ的熱量,則甲烷燃燒的熱化學方程式是( )
A. CH4+2O2→CO2+2H2O+311.4kJ
B. CH4(g)+2O2(g)→CO2(g)+2H2O(l)+311.4kJ
C. CH4(g)+2O2(g)→CO2(g)+2H2O(l)+889.7kJ
D. CH4(g)+2O2(g)→CO2(g)+2H2O(g)+889.7kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知在1×105Pa,298K條件下,2mol氫氣燃燒生成水蒸氣放出484kJ熱量,下列熱化學方程式正確的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯亞砜(SOCl2)是一種無色易揮發液體,劇烈水解生成兩種氣體,常用作脫水劑,其熔點-105℃,沸點79℃,140℃以上時易分解。
(1)用硫黃(S)、液氯和三氧化硫為原料在一定條件合成二氯亞砜,原子利用率達100%,則三者的物質的量比為______________.
(2)甲同學設計如圖裝置用ZnCl2 xH2O晶體制取無水ZnCl2,回收剩余的SOCl2并利用裝置F驗證生成物中的某種氣體(夾持及加熱裝置略)。

①用原理解釋SOCl2在該實驗中的作用______________________________________;加熱條件下,A裝置中總的化學方程式為____________________.
②裝置的連接順序為A→B→_____________________;
③實驗結束后,為檢測ZnCl2 xH2O晶體是否完全脫水,甲同學設計實驗方案如下,正確的實驗順序為_____________(填序號)
a.加入足量硝酸酸化的硝酸銀溶液,充分反應; b.稱得固體為n克; c.干燥;d.稱取蒸干后的固體m克溶于水;e.過濾;f.洗滌
若m/n=______________(保留小數點后一位),即可證明晶體已完全脫水.
(3)乙同學認為SOCl2還可用作由FeCl3 6H2O制取無水FeCl3的脫水劑,但丙同學認為該實驗可能發生副反應使最后的產品不純。
①可能發生的副反應的離子方程式______________________.
②丙同學設計了如下實驗方案判斷副反應的可能性:
i.取少量FeCl3 6H2O于試管中,加入足量SOCl2,振蕩使兩種物質充分反應;
ii.往上述試管中加水溶解,取溶解后的溶液少許于兩支試管,進行實驗驗證,完成表格內容。
(供選試劑:AgNO3溶液、稀鹽酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案 | 操作 | 現象 | 結論 |
方案一 | 往一支試管中滴加_____________ | 若有白色沉淀生成 | 則發生了上述副反應 |
方案二 | 往另一支試管中滴加 _____________ | __________________ | 則沒有發生上述副反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LiFePO4可作為新型鋰離子也池的正極材料。以鈦鐵礦(主要成分為FeTiO3、Fe2O3及少量CuO、SiO2雜質)為主要原料生產TiOSO4,同時得到的綠礬(FeSO4·7H2O)與磷酸和LiOH反應可制各 LiFePO4, LiFePO4的制備流程如下圖所示:

請回答下列問題:
(1)酸溶時 FeTiO3與硫酸反應的化學方程式可表示為____________________。
(2)①加鐵屑還原的目的是__________,②過濾前需要檢驗還原是否完全,其實驗操作可描述為_________。
(3)①“反應”需要按照一定的順序加入FeSO4溶液、磷酸和LiOH,其加入順序應為____________________,②其理由是______________________________。
(4)濾渣中的銅提純后可用于制取Cu2O,Cu2O是一種半導體材料,基于綠色化學理念設計的制取Cu2O的電解池示意圖如下,電解總反應:2Cu+H2O![]() Cu2O+H2↑。則該裝置中銅電極應連接直流電源的__________極,石墨電極的電極反應式為____________________,當有0. 1mol Cu2O生成時電路中轉移__________mol電子。
Cu2O+H2↑。則該裝置中銅電極應連接直流電源的__________極,石墨電極的電極反應式為____________________,當有0. 1mol Cu2O生成時電路中轉移__________mol電子。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組為了探究SO2的性質,設計了如下裝置,

實驗步驟:
①先連接好裝置,檢查氣密性,再加入試劑;
②加熱A試管;
③將銅絲向上抽動離開液面。
(1)A試管中發生反應的化學方程式是______。
(2)B試管中的現象是______。
(3)試管C無明顯現象,某小組取一部分反應后的溶液,分別滴加以下試劑,請你預測能否生成沉淀,若生成沉淀,寫出生成沉淀的化學式。
加入試劑 | 能否生成沉淀 | 沉淀的化學式 |
氯水 | _____________ | __________ |
氨水 | __________ | ___________ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫恒容時,在體積為0.5L的密閉容器中,進行NO2和N2O4之間發生反應N2O4(g)![]() 2NO2(g),如圖所示。
2NO2(g),如圖所示。
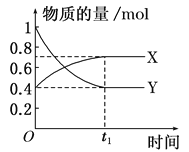
(1)曲線________(填“X”或“Y”)表示NO2的物質的量隨時間變化的曲線。
(2)若升高溫度,則υ(正)________(填“加快”或“減慢”,下同),υ(逆)________。
(3)若t1=10s,則用υ(NO2)=________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,向20 mL 0.1000 mol·L-1 CH3COOH溶液中滴入0.1000 mol·L-1NaOH溶液,滴定曲線如圖所示(忽略溫度變化)。下列說法正確的是
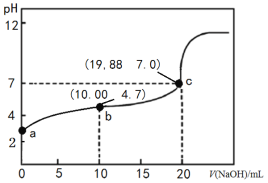
A.該滴定過程應該選擇石蕊溶液做指示劑
B.由c點數值可求醋酸的電離平衡常數為1.66×10-5 mol·L-1
C.b點溶液中各微粒濃度關系為2c(H+)+c(CH3COOH) =c(CH3COO-)+2c(OH-)
D.中和同體積同pH的醋酸和鹽酸所用氫氧化鈉的物質的量,后者多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知![]() 是具有相同電子層結構的短周期元素形成的簡單離子。下列敘述正確的是
是具有相同電子層結構的短周期元素形成的簡單離子。下列敘述正確的是
A.原子半徑: C>D>A>BB.原子序數: b>a>d>c
C.離子半徑: D>C>A>BD.單質還原性: A>B>C>D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com