
【題目】下表是元素周期表的前三周期:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0[ | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三[ | G | H | I | J |
回答下列問題:
(1)J元素的元素的名稱:___________。
(2)G元素與I 元素形成的化合物的電子式是___________,
A、G、E形成的化合物中含有的化學鍵類型為_____________________________。
(3)表格中十種元素的最高氧化物對應的水化物中,酸性最強的是_____________,
屬于兩性氫氧化物的是_______________(用化合物的化學式表示)。
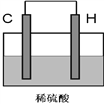
(4)將H單質與C的一種單質(導體)按如下圖裝置連接,其中C極為_________極(填正或負),并寫出該電極反應式為:____________________。
【答案】 氬 ![]() 離子鍵、共價鍵 HClO4 Al(OH)3 正 2H++2e- = H2 ↑
離子鍵、共價鍵 HClO4 Al(OH)3 正 2H++2e- = H2 ↑
【解析】根據元素在周期表中的位置可知,A為H,B為Li,C為C,D為N,E為O,F為F,G為Na,H為Al,I為Cl,J為Ar。
(1)J元素的名稱為氬,故答案為:氬;
(2)G元素與I 元素形成的化合物為氯化鈉,屬于離子化合物,電子式為![]() ,A、G、E形成的化合物為氫氧化鈉,屬于離子化合物,并且氫氧根中含有共價鍵,含有的化學鍵類型有離子鍵、共價鍵,故答案為:離子鍵、共價鍵;
,A、G、E形成的化合物為氫氧化鈉,屬于離子化合物,并且氫氧根中含有共價鍵,含有的化學鍵類型有離子鍵、共價鍵,故答案為:離子鍵、共價鍵;
(3)十種元素的最高氧化物對應的水化物中,酸性最強的是HClO4,屬于兩性氫氧化物的是Al(OH)3,故答案為:HClO4;Al(OH)3;
(4)鋁能夠與硫酸發生氧化還原反應,因此鋁為負極,碳為正極,正極上氫離子得到電子生成氫氣,電極反應式為2H++2e- = H2 ↑,故答案為:正;2H++2e- = H2 ↑。


科目:高中化學 來源: 題型:
【題目】下列有關甲苯的實驗事實中,能說明苯環對側鏈性質產生影響的是( )
A. 甲苯燃燒產生帶濃煙的火焰
B. 甲苯能使酸性KMnO4溶液褪色
C. Cl2既能取代甲苯中苯環上的氫原子,也能取代甲基上的氫原子
D. 甲苯能與H2發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 室溫下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1鹽酸,溶液pH和溫度隨加入鹽酸體積變化曲線如右圖所示。下列有關說法錯誤的是( )

A.室溫下,a點的氨水電離常數為![]()
B.將此氨水稀釋,溶液的導電能力減弱
C.c點時消耗鹽酸體積V(HCl)<20 mL
D.a、d兩點的溶液,水的離子積Kw(a)>Kw(d)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋中有豐富的食品、礦產、能源、藥物和水產資源,下圖為海水利用的部分過程。下列有關說法正確的是
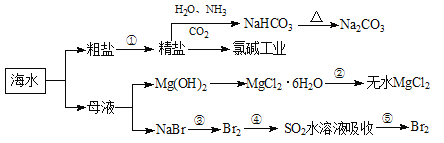
A.第①步中除去粗鹽中的SO![]() 、Ca2+、Mg2+、Fe3+等雜質,加入試劑的順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸
、Ca2+、Mg2+、Fe3+等雜質,加入試劑的順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸
B.制取NaHCO3的反應是利用其溶解度小于NaCl
C.從第③④⑤步的目的是濃縮、富集溴單質,這三步中溴元素均被氧化
D.過程②中結晶出的MgCl2·6H20可在空氣中受熱脫水制得無水MgCl2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期金屬元素甲~戊在元素周期表中的相對位置如右表所示,下面判斷正確的是
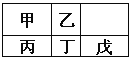
A. 原子半徑:丙<丁<戊
B. 金屬性:甲>丙
C. 氫氧化物堿性:丙>丁>戊
D. 最外層電子數:甲>乙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含有CO、N2、H2、CO2和少量水蒸氣的混合氣體,依次通過足量的灼熱氧化銅、濃氫氧化鈉溶液、濃硫酸后,剩余的氣體是
A.N2 B.N2和H2 C.N2和C02 D.H2和CO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質氧化性、還原性的強弱,不僅與物質的結構有關,還與濃度和反應溫度有關,下列各組物質由于濃度不同而發生不同反應的是:
A. Cu與HNO3 B. Cu與FeCl3 C.Zn與HCl D.FeCl3與NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(14分)A、B、C、D是原子序數依次增大的短周期主族元素,A、C在元素周期表中的相位置如圖,A元素最外層與次外層上的電子數之差為3,B為地殼中含最最多的金屬元素。
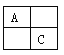
(1)D的離子結構示意圖為_____________。
(2)B、C、D形成的簡單離子半徑由大到小的順序: > > (寫離子符號)
(3)A的最高價氧化物對應的水化物是乙,現將過量Cu加入到60 mL 10.0 mol/L乙的濃溶液中,充分反應,共收集到4.48L(標準狀況)氣體,則該氣體的成分是_________,反應中電子轉移數為____________。若使上述中反應后剩余的銅片繼續溶解,可向其中加入稀硫酸,寫出反應的離子方程式: 。
(4)將兩份足量的B單質分別加入到等體積等濃度的硫酸和NaOH溶液中,充分反應生成氣體的體積比為__________,若將反應后所得的溶液混合,會生成白色沉淀,發生反應的離子方程式為_____________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com