
【題目】實驗室制乙酸乙酯得主要裝置如圖中A所示,主要步驟①在a試管中按2:3:2的體積比配制濃硫酸、乙醇、乙酸的混合物;②按A圖連接裝置,使產生的蒸氣經導管通到b試管所盛的飽和碳酸鈉溶液(加入幾滴酚酞試液)中;③小火加熱a試管中的混合液;④等b試管中收集到約2mL產物時停止加熱.撤下b試管并用力振蕩,然后靜置待其中液體分層;⑤分離出純凈的乙酸乙酯。
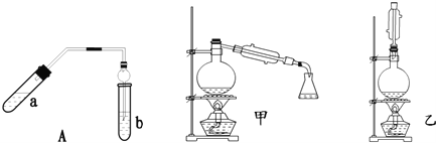
請回答下列問題:
(1)步驟①中,配制這一比例的混合液的正確操作是__;
(2)若實驗中用含18O的乙醇與乙酸作用,該反應得化學方程式是:__;
(3)步驟③中,要用小火加熱,其原因是__;
(4)步驟④中可觀察到b試管中有細小的氣泡冒出,寫出該反應的離子方程式:__;
(5)A裝置中使用球形管除起到冷凝作用外,另一重要作用是__,步驟⑤中分離乙酸乙酯必須使用的一種儀器是__;
(6)為充分利用反應物,甲、乙兩位同學分別設計了圖中甲、乙兩個裝置(乙同學待反應完畢冷卻后,再用飽和碳酸鈉溶液提取燒瓶中的產物),你認為合理的是__。
【答案】 在試管中加入3 mL乙醇,然后邊搖動邊加入2 mL濃硫酸和2 mL乙酸; CH3COOH+CH3CH218OH![]() CH3CO18OC2H5+H2O 防止溫度過高,乙酸乙醇揮發溢出 2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ 防止倒吸 分液漏斗 乙
CH3CO18OC2H5+H2O 防止溫度過高,乙酸乙醇揮發溢出 2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ 防止倒吸 分液漏斗 乙
【解析】
(1)制備乙酸乙酯過程中,濃硫酸起到催化劑和吸水劑的作用;乙酸乙酯的制備反應是可逆反應,為提高反應物的轉化率和提高產率,通常采取增大某反應物的濃度或減小生產物的濃度的方法;(2)酯化反應的本質為酸脫羥基,醇脫氫,該反應生成乙酸乙酯和水,且為可逆反應;(3)乙酸、乙醇的沸點低,易揮發;(4)乙酸的酸性強于碳酸;(5)根據粗產品乙酸乙酯、乙酸和乙醇的混合物中各自的性質,選擇實驗方法和儀器進行解答;(6)根據圖中甲、乙兩個裝置的不同點和制取乙酸乙酯的反應原理進行解答;
(1)乙酸乙酯的制備反應,該反應為可逆反應,濃硫酸的作用為催化劑、吸水劑,吸水利于平衡向生成乙酸乙酯方向移動;因該反應為可逆反應,反應中加入過量的乙醇,平衡向正反應方向移動,CH3COOH的轉化率增大;濃硫酸的密度比乙醇大,所以后加,溶于水放熱,須邊加邊搖放熱混合。步驟①中,配制這一比例的混合液的正確操作是:在試管中加入3 mL乙醇,然后邊搖動邊加入2 mL濃硫酸和2 mL乙酸;(2)實驗中用含18O的乙醇與乙酸作用,酯化反應的本質為酸脫羥基,醇脫氫,該反應生成乙酸乙酯和水,且為可逆反應,所以乙酸脫羥基,乙醇脫氫離子,18O在產物乙酸乙酯中,故答案為:CH3COOH+CH3CH218OH![]() CH3CO18OC2H5+H2O;(3)乙醇沸點78.0℃、乙酸的沸點117.9℃,它們的沸點較低,為防止乙醇、乙酸揮發,應小火加熱,否則易造成原料的損失,步驟③中,要用小火加熱,其原因是:防止溫度過高,乙酸乙醇揮發溢出;(4)步驟④中可觀察到b試管中有細小的氣泡冒出,那是生成了二氧化碳,因乙酸的酸性比碳酸強,所以乙酸能和碳酸鈉反應生成二氧化碳氣體,故2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ ;(5)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而產生倒吸,分離粗產品乙酸乙酯、乙酸和乙醇的混合物,加入飽和碳酸鈉溶液,實現酯與乙酸和乙醇的分離,分離油層和水層采用分液的方法即可,所以用到的儀器為分液漏斗;(6)圖中甲、乙兩個裝置的不同點,乙裝置能將易揮發的反應物乙酸和乙醇冷凝回流到反應容器中,繼續反應,而甲不可。
CH3CO18OC2H5+H2O;(3)乙醇沸點78.0℃、乙酸的沸點117.9℃,它們的沸點較低,為防止乙醇、乙酸揮發,應小火加熱,否則易造成原料的損失,步驟③中,要用小火加熱,其原因是:防止溫度過高,乙酸乙醇揮發溢出;(4)步驟④中可觀察到b試管中有細小的氣泡冒出,那是生成了二氧化碳,因乙酸的酸性比碳酸強,所以乙酸能和碳酸鈉反應生成二氧化碳氣體,故2CH3COOH+CO32﹣→2CH3COO﹣+H2O+CO2↑ ;(5)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而產生倒吸,分離粗產品乙酸乙酯、乙酸和乙醇的混合物,加入飽和碳酸鈉溶液,實現酯與乙酸和乙醇的分離,分離油層和水層采用分液的方法即可,所以用到的儀器為分液漏斗;(6)圖中甲、乙兩個裝置的不同點,乙裝置能將易揮發的反應物乙酸和乙醇冷凝回流到反應容器中,繼續反應,而甲不可。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】乙炔是重要的化工原料,廣泛用于有機合成和氧炔焊等。生產乙炔的方法有多種,如電石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的濃硝酸(硝酸被還原為NO2)在20~70℃時直接氧化為H2C2O4·2H2O。
①該反應的化學方程式為____________________________________________________;
②實際生產中硝酸可循環利用而不被消耗,用方程式說明:__________________。
(2)電石法原理為:由石油焦與生石灰在電爐中生成電石CaC2(含Ca3P2、CaS等雜質),電石與水反應生成C2H2(含PH3及H2S等雜質)。
①已知焦炭固體與氧化鈣固體每生成l g CaC2固體,同時生成CO氣體吸收7.25kJ的熱量,則該反應的熱化學方程式為______________________________________________;
②用CuSO4溶液凈化乙炔氣體,去除PH3的反應之一為:
4CuSO4+PH3+4H2O==4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,該反應中轉移電子的物質的量為__________;
③電石法工藝流程簡單、容易操作、乙炔純度高,缺點是___________________(舉1例)。
(3)甲烷裂解法原理為:2CH4(g)![]() C2H2(g)+3H2(g) △H,實驗測得該反應的Kp(用平衡分壓代替濃度計算的平衡常數,分壓=總壓×物質的量分數)與溫度的關系如下圖所示:
C2H2(g)+3H2(g) △H,實驗測得該反應的Kp(用平衡分壓代替濃度計算的平衡常數,分壓=總壓×物質的量分數)與溫度的關系如下圖所示:
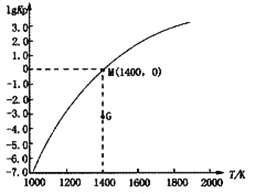
①該反應的△H________0(填“>”、“=”或“<”);
②圖中G點v(正)______v(逆)(填“>”、“=”或“<”);
③M點時,若容器中氣體的總物質的量為1 mol,CH4、C2H2及H2的物質的量分別為a、b、c,則總壓P與a、b、c之間的關系為___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某反應由兩步反應A→B→C構成,它的反應能量曲線如圖所示(E1、E2、E3、E4表示活化能)。下列有關敘述正確的是( )
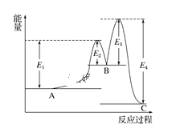
A. 三種化合物中C最穩定B. 加入催化劑會改變反應的焓變
C. 兩步反應均為吸熱反應D. A→C反應中ΔH=E1 - E2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銀鋅電池廣泛用作于各種電子儀器的電源。它的充電放電過程可表示為:2Ag+Zn(OH)2![]() Ag2O +Zn+H2O,
Ag2O +Zn+H2O,
回答下列有關問題:
(1)電池的放電過程是________(填“①”或“②”)。
(2)該電池屬于________(填“酸”“堿”或“中”)性電池。
(3)反應①是________(填“放熱”或“吸熱”)反應。
(4)寫出充電時的電極反應式:
陽極:______________________,
陰極:______________________。
(5)充電時,電池的陽極應接電源的________極。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A,B,C,D是四種短周期元素,E是過渡元素。A,B,C同周期,C,D同主族,A的原子結構示意圖為 ,B是同周期第一電離能最小的元素,C的最外層有三個未成對電子,E的外圍電子排布式為3d64s2。試回答下列問題:
,B是同周期第一電離能最小的元素,C的最外層有三個未成對電子,E的外圍電子排布式為3d64s2。試回答下列問題:
(1)寫出下列元素的符號:A__________,B__________,C__________,D__________。
(2)用化學式表示上述五種元素中最高價氧化物對應水化物酸性最強的是________,堿性最強的是__________。
(3)用元素符號表示D所在周期第一電離能最大的元素是________,電負性最大的元素是__________。
(4)E元素原子的核電荷數是__________,E元素在周期表的第________周期第________族,已知元素周期表可按電子排布分為s區、p區等,則E元素在________區。
(5)寫出D元素原子構成單質的電子式__________,該分子中有____個σ鍵,____個π鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應:2NO2![]() 2NO+O2在固定體積的密閉容器中反應,達到平衡狀態的標志是 ( )
2NO+O2在固定體積的密閉容器中反應,達到平衡狀態的標志是 ( )
(1)單位時間內生成n mol O2的同時生成2n mol NO2
(2)單位時間內生成n mol O2的同時,生成2n mol NO
(3)用NO2 、NO、O2的物質的量濃度變化表示的反應速率的比為2:2:2的狀態
(4)混合氣體的顏色不再改變的狀態
(5)混合氣體的平均相對分子質量不再改變的狀態
A. 僅(1)(4)(5) B. 僅(2)(3)(5)
C. 僅(1)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向火箭燃料液態聯氨(N2H4)中加入催化劑,發生反應:N2H4(l)=N2(g)+2H2(g) △H。
已知: ①3N2H4(l)=4NH3(g)+ N2(g) △H1=-336.6kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g)△H2=-92.4kJ·mol-1。
2NH3(g)△H2=-92.4kJ·mol-1。
下列說法錯誤的是
A. 使用催化劑后,反應②的正、逆反應的活化能都減小,但△H1不變
B. △H=-151.8kJ·mol-1
C. 將28g N2和10mol H2混合充分反應,放出的熱量一定小于92.4 kJ
D. 聯氨作為火箭燃料是一種清潔能源
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在U形管中用惰性電極電解硫酸鈉和石蕊的混合液,一段時間后,可以觀察到的現象是( )
A. 兩極附近顏色無明顯變化 B. 兩極產生等量氣體
C. 陽極附近的顏色變紅 D. 陰極附近的顏色變紅
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com