
【題目】在密閉容器中發生反應I2(g) + H2(g)![]() 2HI(g) ΔH =-14.9 kJ·mol-1,能說明反應已經達到化學平衡狀態的是
2HI(g) ΔH =-14.9 kJ·mol-1,能說明反應已經達到化學平衡狀態的是
A.各物質的濃度相等
B.反應容器內壓強不變
C.容器內顏色不再變化
D.單位時間內斷裂a mol H-H鍵,同時形成2a mol H-I鍵
科目:高中化學 來源: 題型:
【題目】在一定條件下的定容密閉容器中,當物質的下列物理量不再變化時,不能說明反應A(s) + 2B(g)![]() C(g) + D(g) 已達平衡狀態的是
C(g) + D(g) 已達平衡狀態的是
A. 混合氣體的壓強 B. 混合氣體的密度
C. B的物質的量濃度 D. 氣體的平均相對分子質量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用0.100 mol·L-1的KOH標準溶液滴定未知濃度的鹽酸,其操作可分解為如下幾步:
A.移取20 mL待測鹽酸溶液注入潔凈的錐形瓶中,并加入2~3滴酚酞;
B.用標準溶液潤洗滴定管2~3次;
C.把盛有標準溶液的堿式滴定管固定好,調節滴定管使尖嘴處充滿溶液;
D.取標準KOH溶液注入堿式滴定管至刻度“0”以上2~3 cm 處;
E.調節液面至“0”或“0”以下刻度,記下讀數;
F.把錐形瓶放在滴定管的下面,用標準KOH溶液滴定至終點并記下滴定管液面的刻度。
就此實驗完成填空:
(1)正確操作步驟的順序是(用序號字母填寫)__________________________。
(2)上述B步驟操作的目的是__________________________________________。
(3)上述A步驟操作之前,若先用待測溶液潤洗錐形瓶,則滴定結果______(填“偏高“、“偏低”或“不變”)
(4)判斷到達滴定終點的實驗現象是________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究化學反應與能量的變化具有重要意義。
![]() 已知
已知![]() 的反應過程的能量變化如圖1:
的反應過程的能量變化如圖1:

![]() 該反應通常用
該反應通常用![]() 作為催化劑,加入
作為催化劑,加入![]() 會使圖中的B點________
會使圖中的B點________![]() 填“升高”、“不變”或“降低”
填“升高”、“不變”或“降低”![]() 。
。
![]() E
E![]() 表示的意義為___________。
表示的意義為___________。
![]() 如圖2中的a和b為氫鎳可充電堿性電池的電極,該電池總反應式為:
如圖2中的a和b為氫鎳可充電堿性電池的電極,該電池總反應式為:![]()
![]() 為了實現銅與稀硫酸反應,用Z通入氧氣的同時,將開關K與Y相連即可。石墨電極的反應式為___________,總反應的化學方程式為__________。
為了實現銅與稀硫酸反應,用Z通入氧氣的同時,將開關K與Y相連即可。石墨電極的反應式為___________,總反應的化學方程式為__________。
![]() 不通入氧氣,直接將K與X相連也能實現銅與稀硫酸反應。則氫鎳堿性電池的負極為____
不通入氧氣,直接將K與X相連也能實現銅與稀硫酸反應。則氫鎳堿性電池的負極為____![]() 填“a”或“b”
填“a”或“b”![]() ,電解槽內總反應的離子方程式為______________________。
,電解槽內總反應的離子方程式為______________________。
![]() 當給氫鎳堿性電池充電時,該電池的正極反應式為______;氫鎳電池放電時,負極附近的pH會________
當給氫鎳堿性電池充電時,該電池的正極反應式為______;氫鎳電池放電時,負極附近的pH會________![]() 填“變大”、“不變”或“變小”
填“變大”、“不變”或“變小”![]() 。
。
![]() 若將
若將![]() 題圖2中的稀硫酸換成
題圖2中的稀硫酸換成![]() 溶液,并且將氫鎳堿性電池的電極反接,將K連接X,通電一段時間后,向所得溶液中加入
溶液,并且將氫鎳堿性電池的電極反接,將K連接X,通電一段時間后,向所得溶液中加入![]() 堿式碳酸銅
堿式碳酸銅![]() 后,恰好恢復到原來的濃度和
后,恰好恢復到原來的濃度和![]() 不考慮
不考慮![]() 的溶解
的溶解![]() ,則電解過程中轉移電子的物質的量為__________。
,則電解過程中轉移電子的物質的量為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化二硫(S2Cl2)是一種重要的化工原料,常用作橡膠硫化劑,改變生橡膠受熱發粘、遇冷變硬的性質。查閱資料可知S2Cl2具有下列性質:
物理性質 | 毒性 | 色態 | 揮發性 | 熔點 | 沸點 |
劇毒 | 金黃色液體 | 易揮發 | -76℃ | 138℃ | |
化學性質 | ①300℃以上完全分解;②S2Cl2+Cl2 ③遇高熱或與明火接觸,有引起燃燒的危險 ④受熱或遇水分解放熱,放出腐蝕性煙氣 | ||||
(1)制取少量S2Cl2
實驗室可利用硫與少量氯氣在110~140℃反應制得S2Cl2粗品,氯氣過量則會生成SCl2。

①儀器m的名稱為__,裝置F中的試劑作用是__。
②裝置連接順序:__→__→__→__→__→D。__
③實驗前打開K1,通入一段時間的氮氣排盡裝置內空氣。實驗結束停止加熱后,再通入一段時間的氮氣,其目的是__。
④為了提高S2Cl2的純度,實驗的關鍵是__。(寫兩點)
(2)S2Cl2有劇毒,少量S2Cl2泄漏時應噴水霧減慢其揮發(或擴散)。S2Cl2遇水會生成SO2、HCl兩種氣體,寫出該反應的化學方程式__。
(3)某同學設計了如下實驗方案來測定S2Cl2與水反應后的混合氣體中SO2的體積分數。
![]()
①W溶液可以是__(填標號)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②該混合氣體中二氧化硫的體積分數為__(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應C(s)+H2O(g)![]() CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡體系中H2百分含量,又能加快反應速率的措施是
CO(g)+H2(g),ΔH=+206.4 kJ·mol-1,一定可以提高平衡體系中H2百分含量,又能加快反應速率的措施是
A.升高溫度B.增大水蒸氣濃度
C.加入大量CD.降低壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組分別用下圖所示裝置對原電池和電解原理進行實驗探究.
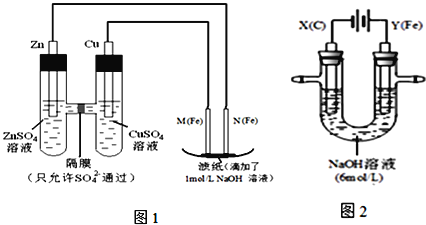
請回答:
I.用圖1所示裝置進行第一組實驗.
(1)在保證電極反應不變的情況下,不能替代Cu做電極的是______(填字母序號).
A.鋁 B.石墨 C.銀 D.鉑
(2)N極發生反應的電極反應式為_____________.
(3)實驗過程中,SO42-______(填“從左向右”、“從右向左”或“不”)移動;濾紙上能觀察到的現象有______________.
II.用圖2所示裝置進行第二組實驗.實驗過程中,兩極均有氣體產生,Y極區溶液逐漸變成紫紅色;停止實驗,鐵電極明顯變細,電解液仍然澄清.查閱資料發現,高鐵酸根(FeO42-)在溶液中呈紫紅色.
(4)電解過程中,X極區溶液的pH______(填“增大”、“減小”或“不變”).
(5)電解過程中,Y極發生的電極反應為_____________和4OH-- 4e-= 2H2O + O2↑
(6)若在X極收集到672mL氣體,在Y極收集到168mL氣體(均已折算為標準狀況時氣體體積),則Y電極(鐵電極)質量減少______g.
(7)在堿性鋅電池中,用高鐵酸鉀作為正極材料,電池反應為:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 該電池正極發生的反應的電極反應式為__________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】TiCl4是制備鈦及其化合物的重要中間體,可利用下列裝置在實驗室制備TiCl4(夾持裝置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
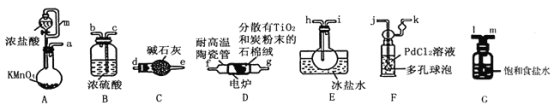
已知:①PdCl2溶液捕獲CO時生成Pd單質;②相關數據如下表:
化合物 | 熔點/℃ | 沸點/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有機溶劑:遇水分解生成難溶于水的物質 |
CCl4 | -23 | 76.8 | 1.6 | 難溶于水 |
回答下列問題:
(1)裝置A中連通管的作用是______;裝置E中使用冰鹽水浴的目的是_____________________。
(2)按照氣流由左到右的方向,上述裝置合理的連接順序為____________________ (填儀器接口字母);根據完整的實驗裝置進行實驗,實驗步驟如下:_____________; 裝入藥品;向裝置A燒瓶中滴加適量濃鹽酸,當觀察到_________時,加熱裝置D中陶瓷管;裝置E燒瓶中的液體量不再增加時,停止加熱,充分冷卻。
(3)裝置C的作用為___________________。
(4)裝置F中發生反應的化學方程式為________________________。
(5)制得的TiCl4中常含有少量CCl4, 從混合液體中分離出TiCl4的操作名稱為_______________。
(6)利用如圖所示裝置測定產品純度:稱取w g TiCl4產品進行實驗,向安全漏斗中加入適量蒸餾水,待四氯化鈦充分反應后,將燒瓶和安全漏斗中的液體一并轉入錐形瓶中,用氫氧化鈉溶液調節至中性,滴加幾滴0.1 molL-1的K2CrO4溶液作指示劑,用cmol L-1 AgNO3標準溶液滴定至終點( Ag2CrO4為紅棕色沉淀,可指示滴定終點),重復滴定兩次,平均消耗標準溶液V mL。
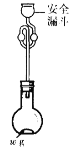
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本實驗中的作用除加水外,還有___________。
②根據上述數據計算該產品的純度為__________。(用含w、c和V的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在工業生產上中,主要用Na2SO3制造亞硫酸纖維素酯、硫代硫酸鈉、有機化學藥品、漂白織物等。但Na2SO3在空氣中易氧化為Na2SO4而變質。為了求出變質樣品中Na2SO3的含量,采用0.2 mol·L-1KMnO4酸性溶液滴定用樣品配制的溶液。反應離子方程式是:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O,稱取20 g樣品,配成250 mL溶液,量取25 mL進行滴定,記錄數據,再重復2次實驗。
填空完成問題:
(1)滴定實驗不需要下列儀器中的________。
A.酸式滴定管(50 mL) B.堿式滴定管(50 mL) C.量筒(10 mL) D.錐形瓶 E.鐵架臺 F.滴定管夾
G.白紙 H.玻璃棒
(2)已知滴定過程不需要指示劑,理由是_______________________。
(3)下列操作中可能使所測Na2SO3溶液的濃度數值偏低的是________(填字母)。
A.盛放Na2SO3溶液的滴定管沒有使用Na2SO3溶液潤洗
B.錐形瓶內有水殘留,沒有烘干,裝入待測的Na2SO3溶液滴定
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取KMnO4溶液體積時,開始仰視讀數,滴定結束時俯視讀數
(4)滴定完畢,三次實驗平均消耗0.2 mol·L-1KMnO4酸性溶液20.00mL,則樣品中Na2SO3的百分含量為:_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com