
【題目】Ⅰ.從海水得到的粗食鹽水中常含Ca2+、Mg2+、SO42-,需要分離提純.現有含少量CaCl2、MgSO4的粗食鹽水,在除去懸浮物和泥沙之后,要用4種試劑(1)鹽酸、(2)Na2CO3、(3)NaOH、(4)BaCl2來除去食鹽水中Ca2+、Mg2+、SO42-。提純的操作步驟和加入試劑的情況如圖1:

圖中a、b、c、d分別表示上述4種試劑中的一種,試回答:
(1)生成沉淀A的化學方程式___________________________________;
(2)試劑d是________;判斷試劑d已經足量的簡單方法_______________________________;如果在加入d試劑前沒有過濾,引起的后果是___________________________________。
(3)沉淀B、C、D的化學式分別為(不講順序)__________,_____________,____________;
(4)現有如圖2儀器,過濾出沉淀A、B、C、D時必須用到______________(填序號)。

Ⅱ.海水蒸餾是由海水獲得淡水的常用方法之一,在實驗室里組成一套蒸餾裝置肯定需要上述儀器中的_______________________(填序號);實驗時②中除加入適量海水外,還需加入_____,其作用是_________________________。
Ⅲ.海帶等藻類物質經過處理后,可以得到碘水,欲從碘水中提取碘,需要上述中的儀器,該儀器名稱為____________。為了使該儀器中液體可以順利流下,應進行的具體操作是__________。向該碘水中加入四氯化碳以提取碘單質的實驗操作為___________________。
【答案】MgSO4+BaCl2 =BaSO4↓+MgCl2鹽酸(HCl)溶液中不再產生氣體生成的沉淀溶與酸反應,并不能除去雜質離子(答案意思相近即可)CaCO3BaCO3Mg(OH)2④②③⑤⑥沸石(碎瓷片)防止暴沸分液漏斗打開分液漏斗上端活塞或使凹孔對準小孔萃取(分液)
【解析】
鎂離子用氫氧根離子沉淀,加入過量的氫氧化鈉可以將鎂離子沉淀;硫酸根離子用鋇離子沉淀,加入過量的氯化鋇可以將硫酸根離子沉淀;至于先除鎂離子,還是先除硫酸根離子都行;鈣離子用碳酸根離子沉淀,除鈣離子加入碳酸鈉轉化為沉淀;但是加入的碳酸鈉要放在加入氯化鋇之后,這樣碳酸鈉會除去反應剩余的氯化鋇,使離子都沉淀了,再進行過濾,最后再加入鹽酸除去反應剩余的氫氧根離子和碳酸根離子。
(1).用(1)鹽酸; (2)Na2CO3、(3)NaOH、(4)BaCl24種試劑來除去食鹽水中Ca2+、Mg2+、SO42-離子,結合上面分析,加入試劑的順序是(4)(3)(2)(1)。氯化鋇可以將硫酸根離子沉淀,反應的化學方程式為MgSO4+BaCl2 =BaSO4↓+MgCl2:,因此,本題答案是MgSO4+BaCl2 =BaSO4↓+MgCl2。
(2)試劑d是鹽酸,鹽酸可以和碳酸根離子之間反應生成水和二氧化碳,當不再產生二氧化碳時,證明鹽酸已經過量。因為生成的沉淀為CaCO3、BaCO3、Mg(OH)2,d試劑為鹽酸,如果在加入d試劑之前前沒有過濾,引起的后果是生成的沉淀溶與鹽酸反應,達不到除去雜質離子的目的。因此,本題答案是:鹽酸;溶液中不會再產生氣體,生成的沉淀溶與鹽酸反應,并不能除去雜質離子。
(3)濾液中加稍過量的氫氧化鈉,把鎂離子生成氫氧化鎂沉淀,加入稍過量碳酸鈉,鈣離子及過量的鋇離子生成碳酸鈣、碳酸鋇沉淀,故沉淀B、C、D分別為碳酸鈣、碳酸鋇、氫氧化鎂沉淀。因此,本題答案是: CaCO3 、BaCO3 、Mg(OH)2;
(4)過濾實驗用到的儀器:漏斗、玻璃棒、燒杯等,根據實驗裝置,過濾出沉淀A、B、C、D時必須用到漏斗,因此,本題正確答案是:(4);
Ⅱ、蒸餾裝置需要的儀器有:酒精燈、蒸餾燒瓶、單孔塞、冷凝管、牛角管、錐形瓶, 實驗時②中除加入適量海水外,還需加入沸石(碎瓷片),其作用是防止暴沸。因此,本題答案是:(2)(3)(5)(6); 沸石(碎瓷片)防止暴沸。
Ⅲ、從碘水中提取碘,可以采取萃取分液操作,使用的萃取劑是四氯化碳,使用的儀器是分液漏斗,為了使該儀器中液體可以順利流下,應進行的具體操作是打開分液漏斗上端活塞或使凹孔對準小孔。答案:分液漏斗、打開分液漏斗上端活塞或使凹孔對準小孔、萃取(分液)


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某化學小組采用類似制乙酸乙酯的裝置,用環己醇制備環己烯:
已知: 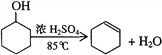
密度(g/cm3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
環己醇 | 0.96 | 25 | 161 | 能溶于水 |
環己烯 | 0.81 | -103 | 83 | 難溶于水 |
(1)制備粗品:采用如圖1所示裝置,用環己醇制備環己烯。
將12.5 mL環己醇加入試管A中,再加入1 mL濃硫酸,搖勻放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
①A中碎瓷片的作用是_____________,導管B的作用是_______________。
②試管C置于冰水浴中的目的是________________________。
(2)制備精品:
①環己烯粗品中含有環己醇和少量有機酸性雜質等。加入飽和食鹽水,振蕩、靜置、分層,環己烯在______層(填“上”或“下”),分液后用________洗滌(填字母)。
A. KMnO4溶液 B. 稀H2SO4 C. Na2CO3溶液
②再將環己烯按圖2裝置蒸餾,冷卻水從____口(填字母)進入。蒸餾時加入生石灰,目的是______________________________________。
③收集產品時,控制的溫度應在______左右,實驗制得的環己烯精品質量低于理論產量,可能的原因是______(填字母)。
a. 蒸餾時從70℃開始收集產品
b. 環己醇實際用量多了
c. 制備粗品時環己醇隨產品一起蒸出
(3)以下區分環己烯精品和粗品的方法,合理的是________(填字母)。
a. 用酸性高錳酸鉀溶液
b. 用金屬鈉
c. 測定沸點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖甲是利用一種微生物將廢水中的尿素[CO(NH2)2] 的化學能直接轉化為電能,并生成環境友好物質的裝置,同時利用此裝置的電能在鐵上鍍銅。下列說法中正確的是

A. 銅電極應與X相連接
B. M電極反應式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
C. 當N電極消耗0.25mol氣體時,則鐵電極增重16g
D. H+進過質子交換膜由右向左移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋇鹽生產過程中排出大量鋇泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某工廠本著資源利用和降低生產成本的目的。在生產BaCO3同時,充分利用鋇泥來制取Ba(NO3)2晶體及其它副產品,其部分工藝流程如下:
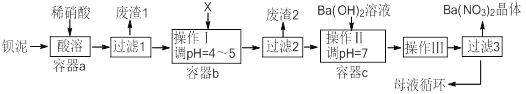
已知: ①Fe(OH)3和Fe(OH)2完全沉淀時溶液的pH分別為3.2和9.7
②Ba(NO3)2在熱水中的溶解度大,在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10Ksp(BaCO3)=5.1×10-9
(1)該廠生產的BaCO3因含有少量BaSO4而不純,提純的方法是:將產品加入足量飽和的Na2CO3溶液中充分攪拌、過濾、洗滌。用離子方程式說明該提純的原理 。
(2)上述流程中Ba(FeO2)2與HNO3溶液反應生成兩種鹽,反應的化學方程式為 。
(3)結合本廠生產實際,X試劑應選下列中的 。
A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)廢渣2為 。
(5)操作III為 。
(6)過濾III后的母液應循環到容器 中(選填a、b、c) 。
(7)稱取w克的晶體樣品溶于蒸餾水中加入足量的稀硫酸,反應后經一系列操作稱重所得沉淀質量為m克,則該晶體的純度可表示為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以乙炔為原料在一定條件下可轉化為乙烯基乙炔(CH≡C—CH=CH2)。下列關于乙烯基乙炔分子的說法錯誤的是( )
A. 能使酸性KMnO4溶液褪色
B. 1 mol乙烯基乙炔能與3 mol Br2發生加成反應
C. 乙烯基乙炔分子中含有兩種官能團
D. 等質量的乙炔與乙烯基乙炔完全燃燒時耗氧量不相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖1是細胞中化合物含量的扇形圖,圖2是有活性的細胞中元素含量的柱形圖,下列說法不正確的是( )

A. 若圖1表示細胞鮮重,則A、B化合物依次是H2O、蛋白質
B. 若圖2表示組成人體細胞的元素含量,則a、b、c依次是O、C、H
C. 地殼與活細胞中含量最多的元素都是a,因此說明生物界與非生物界具有統一性
D. 若圖1表示細胞完全脫水后化合物的含量,則A化合物具有多樣性,其中含的元素為C、H、O、N
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖1是細胞中3種化合物含量的扇形圖,圖2是有活性的細胞中元素含量的柱形圖, 下列說法錯誤的是
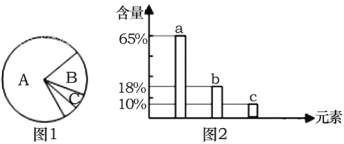
A. 若圖1表示正常細胞的化合物含量,則化合物A、B共有的元素中含量最多的是圖2中 的a
B. 若圖1表示細胞完全脫水后的化合物含量,則化合物A中含量最多的元素為圖2中的 b
C. 若圖1表示正常細胞的化合物含量,則化合物B具有多樣性,其必含的元素為C、H、O、N
D. 圖2中數量最多的元素是碳,這與細胞中含量最多的化合物有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:常溫下,0.01 mol/L MOH溶液的pH為10,MOH(aq)與H2SO4(aq)反應生成1 mol正鹽的ΔH=-24.2 kJ·mol-1,強酸與強堿的稀溶液的中和熱為ΔH=-57.3 kJ·mol-1。則MOH在水溶液中電離的ΔH為( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式不正確的是( )
A.鐵與稀鹽酸反應:2Fe+6H+═2Fe3++3H2↑
B.氫氧化鈉與鹽酸反應:OH﹣+H+═H2O
C.鋅與硫酸銅溶液反應:Zn+Cu2+═Zn2++Cu
D.氯化鋇溶液與稀硫酸反應:Ba2++SO42﹣═BaSO4↓
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com