
【題目】堿式氯化鎂(MgOHCl)常用作塑料添加劑,工業上制備方法較多,其中利用氫氧化鎂熱分解氯化銨制氨氣并得到堿式氯化鎂的工藝屬于我國首創。某中學科研小組根據該原理設計如下裝置圖進行相關實驗,裝置C中CuO的質量為8.0 g。
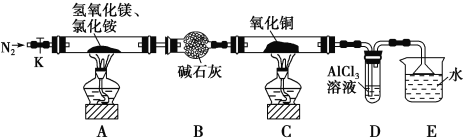
請回答下列問題:
(1)裝置A中發生反應生成堿式氯化鎂的化學方程式為:_____________________________。
(2)裝置D中生成沉淀,發生反應的離子方程式為_________________________________。
(3)反應過程中持續通入N2的作用有兩點:一是: 將裝置A中產生的氨氣完全導出,二是:_______________________________。
(4)若測得堿石灰的質量增加了a g,則得到堿式氯化鎂的質量為_______g。
(5)反應完畢,裝置C中的氧化銅全部由黑色變為紅色,稱其質量為6.8 g,且生成的氣體可直接排放到大氣中,則紅色固體是_______,該反應中轉移電子的物質的量為_______mol。
(6)請你設計一個實驗方案證明裝置C中的氧化銅反應完全后得到的紅色固體中含有氧化亞銅。已知:①Cu2O+2H+===Cu2++Cu+H2O
②限選試劑:2 mol·L-1H2SO4溶液、濃硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
實驗步驟 | 預期現象和結論 |
步驟1:取反應后裝置C中的少許固體于試管中 | |
步驟2:____________ | ____________ |
【答案】Mg(OH)2+NH4Cl![]() MgOHCl+NH3↑+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH 稀釋氨氣,防止倒吸 4.25a Cu和Cu2O 0.15 向試管中加入適量2 mol·L-1H2SO4溶液 溶液變成藍色,說明紅色固體中含有Cu2O
MgOHCl+NH3↑+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH 稀釋氨氣,防止倒吸 4.25a Cu和Cu2O 0.15 向試管中加入適量2 mol·L-1H2SO4溶液 溶液變成藍色,說明紅色固體中含有Cu2O
【解析】
A中反應得到MgOHCl,還生成NH3與H2O,堿石灰干燥氨氣,C中氨氣與氧化銅反應會得到氮氣與水,D最過氧化鈉水反應生成氧氣,D中氨氣與氧氣發生催化氧化,F中NO與氧氣反應得到二氧化氮,G中二氧化氮溶解得到硝酸,硝酸與Cu反應。據此分析解答。
(1)A中氫氧化鎂與氯化銨再加熱條件下反應生成MgOHCl、NH3與H2O,反應方程式為:Mg(OH)2+NH4Cl ![]() MgOHCl+NH3↑+H2O,故答案為:Mg(OH)2+NH4Cl
MgOHCl+NH3↑+H2O,故答案為:Mg(OH)2+NH4Cl ![]() MgOHCl+NH3↑+H2O;
MgOHCl+NH3↑+H2O;
(2)氨水和氯化鋁反應生成氯化銨和氫氧化鋁,反應的離子方程式為Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案為:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
(3)G中二氧化氮、氨氣極易溶于水,溶解會導致倒吸,通入氮氣可以稀釋氨氣,防止倒吸,故答案為:稀釋氨氣,防止倒吸;
(4)若測得堿石灰的質量增加了a g,即生成的水的質量為ag,根據Mg(OH)2+NH4Cl ![]() MgOHCl+NH3↑+H2O,生成的堿式氯化鎂的質量為
MgOHCl+NH3↑+H2O,生成的堿式氯化鎂的質量為![]() ×76.5g/mol=4.25a g,故答案為:4.25a;
×76.5g/mol=4.25a g,故答案為:4.25a;
(5)紅色物質為Cu或Cu2O或二者混合物,固體質量減少質量為減少的氧元素質量,則減少的氧元素質量為8g-6.8g=1.2g,而CuO中氧元素質量為8.0g× ![]() =1.6g>1.2g,故紅色固體為Cu、Cu2O混合物,設二者物質的量分別為xmol、ymol,則:x+2y=
=1.6g>1.2g,故紅色固體為Cu、Cu2O混合物,設二者物質的量分別為xmol、ymol,則:x+2y=![]() ,64x+144y,解得x=0.05,y=0.025,則轉移電子為0.05mol×2+0.025mol×2=0.15mol,故答案為:Cu和Cu2O;0.15;
,64x+144y,解得x=0.05,y=0.025,則轉移電子為0.05mol×2+0.025mol×2=0.15mol,故答案為:Cu和Cu2O;0.15;
(6)Cu能與濃硫酸反應,Cu2O能與稀酸反應得到Cu2+,用稀H2SO4溶液溶解,溶液中出現藍色,說明紅色固體中含有Cu2O,故答案為:向試管中加入適量2 mol·L-1H2SO4溶液;溶液變成藍色,說明紅色固體中含有Cu2O。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】下列敘述不正確的是( )
A. 可以用NaOH溶液鑒別MgCl2和AlCl3 B. 可以用溴水鑒別甲烷和乙烯
C. 可以用分液漏斗分離乙酸和乙醇 D. 可以用NaOH溶液除去苯中少量的Br2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式為CH3—CH=CH—Cl,該有機物能發生( )
①取代反應 ②加成反應 ③消去反應 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色 ⑥與AgNO3溶液反應生成白色沉淀 ⑦加聚反應
A.以上反應均可發生B.只有⑦不能發生
C.只有⑥不能發生D.只有②不能發生
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在常溫常壓下斷裂1 mol指定共價鍵時吸收的能量如下表:
共價鍵(1mol) | C—H鍵 | C—C鍵 | C=C鍵 | H—H鍵 |
吸收的能量/kJ | 413.4 | 347.7 | 615 | 436 |
則下列有關CH2=CH2+H2—→CH3CH3反應的說法正確的是( )
A. 生成1mol乙烷時反應放出能量123.5kJ
B. 生成物的總能量為2828.1kJ
C. 該反應為加成反應,可以實現完全轉化
D. 該反應為放熱反應,無需加熱即可實現
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列圖示所得出的結論不正確的是

A. 圖甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常數與反應溫度的關系曲線,說明該反應的ΔH<0
CO2(g)+H2(g)的平衡常數與反應溫度的關系曲線,說明該反應的ΔH<0
B. 圖乙是室溫下H2O2催化分解放出氧氣的反應中c(H2O2 )隨反應時間變化的曲線,說明隨著反應的進行H2O2分解速率逐漸減小
C. 圖丙是室溫下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲線,說明HX是一元強酸
D. 圖丁是室溫下用Na2SO4除去溶液中Ba2+達到沉淀溶解平衡時,溶液中c(Ba2+ )與c(SO42)的關系曲線,說明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈧及其化合物具有許多優良的性能,在宇航、電子、超導等方面有著廣泛的應用。從鈦白工業廢酸(含鈧、鈦、鐵、錳等離子)中提取氧化鈧(Sc2O3)的一種流程如下:

回答下列問題:
(l)洗滌“油相”可除去大量的鈦離子。洗滌水是用93%的硫酸、27.5%的雙氧水和水按一定比例混合而成。混合的實驗操作是__________。
(2)先加入氨水調節pH =3,過濾,濾渣主要成分是_______;再向濾液加入氨水調節pH=6,濾液中Sc3+的濃度為________。[己知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31]
(3)用草酸“沉鈧”。25℃時pH=2的草酸溶液中![]() =_______(保留兩位有效數字)。寫出“沉鈧”得到草酸鈧的離子方程式_________。
=_______(保留兩位有效數字)。寫出“沉鈧”得到草酸鈧的離子方程式_________。
(已知Kal(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5)
(4)草酸鈧“灼燒”氧化的化學方程式為_____________。
(5)廢酸中含鈧量為15mg/L,V L廢酸最多可提取Sc2O3的質量為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 需要加熱才能發生的反應是吸熱反應
B. 吸熱反應一定需要加熱才能發生
C. 所有的分解反應都是吸熱反應
D. 需要持續加熱才能發生的反應是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知CO和H2在一定條件下合成甲醇的反應為:CO(g)+2H2(g)![]() CH30H(g),現在容積均為l L的a、b、c三個密閉容器中分別充入l molCO和2mol H2的混合氣體,控制溫度,進行反應,測得相關數據的關系如圖l和圖2所示。下列說法正確的是( )
CH30H(g),現在容積均為l L的a、b、c三個密閉容器中分別充入l molCO和2mol H2的混合氣體,控制溫度,進行反應,測得相關數據的關系如圖l和圖2所示。下列說法正確的是( )
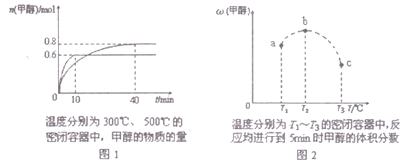
A. 該反應的正反應的△H>0
B. 升溫或減壓,可將b中的平衡狀態轉變成從c中的平衡狀態
C. 反應進行到5min時,a容器中v(正)= v(逆)
D. 達到平衡時,a、b、c中CO轉化率為b>a>c
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質除雜和分離方法正確的是( )
被提純物質 | 除雜試劑 | 分離方法 | |
A | 苯(苯甲酸) | 生石灰 | 蒸餾 |
B | 乙酸乙酯(乙酸) | 氫氧化鈉溶液 | 分液 |
C | 乙烷(乙烯) | 酸性高錳酸鉀溶液 | 洗氣 |
D | 苯(苯酚) | 濃溴水 | 過濾 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com