
【題目】若H2S的燃燒熱化學方程式為H2S(g)+aO2(g)=X+cH2O(1)△H,則X應為( )
A. S(s) B. SO2(g) C. SO3(g) D. SO3(1)
 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:
【題目】在密閉容器中充入CO和CO2的混合氣體,其密度是相同條件下氦氣密度的8倍,這時測得容器內壓強為P1,若控制容器的體積不變,加入足量的過氧化鈉,并不斷用電火花點燃至完全反應,恢復到開始的溫度,再次測得容器內的壓強為P2,則P1和P2關系是
A. P1=8P2 B. P1=4P2 C. P1=2P2 D. P1=P2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下的恒溫恒容密閉容器中發生反應X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1mol/L、0.3mol/L、0.08mol/L。則下列判斷正確的是
2Z(g),若X、Y、Z的起始濃度分別為c1、c2、c3(均不為零),達到平衡時,X、Y、Z的濃度分別為0.1mol/L、0.3mol/L、0.08mol/L。則下列判斷正確的是
A. c1:c2=1:2 B. 平衡時,Y和Z的生成速率之比為2:3
C. 若反應正向進行,X、Y的轉化率不相等 D. c1的取值范圍為0<c1<0.14mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關物質的分類正確的是( )
A.CaCl2、NaOH、HCl、HD四種物質都屬于化合物
B.硫酸、純堿、醋酸鈉和生石灰分別屬于酸、堿、鹽和氧化物
C.溶液,濁液,膠體都屬于混合物
D.CO2、CO等非金屬氧化物均屬于酸性氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某鐵礦石(若只含鐵的氧化物和SiO2)取36g溶于過量的稀鹽酸中,過濾、洗滌、干燥后得5.6g不溶物,向得到的濾液中加入足量的NaOH溶液,過濾、洗滌后將沉淀灼燒,得32g紅棕色固體.根據題意下列結論不正確的是( )
A. 由鐵礦石轉化為紅棕色固體的過程中發生了氧化還原反應
B. 溶于鹽酸后得到的濾液中n(Fe2+):n(Fe3+)=1:1
C. 鐵礦石中的鐵的氧化物的化學式一定是Fe3O4
D. 若稀鹽酸為3.0molL﹣1 400mL,反應前后體積變化忽略不計,則濾液中剩余H+的物質的量濃度是0.5molL﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】晶須是由高純度單晶生長而成的微納米級的短纖維,工業應用的晶須主要是在人工控制條件下合成。
碳酸鎂晶須(MgCO3·nH2O,n = 1~5的整數)廣泛應用于冶金、耐火材料及化工產品等領域。制取碳酸鎂晶須的步驟如圖:
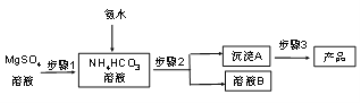
完成下列填空:
(1)步驟1必須將反應的溫度控制在50℃,較好的加熱方法是_______________________;氨水、硫酸鎂、碳酸氫銨三者反應,除生成MgCO3·nH2O沉淀外,同時生成的產物還有______________________________________。
(2)步驟2是__________、洗滌,檢驗沉淀A已洗滌干凈的方法是_____________________。
為測定碳酸鎂晶須產品中n的值,某興趣小組設計了如下裝置,并進行了三次實驗。(不考慮稀鹽酸的揮發性)
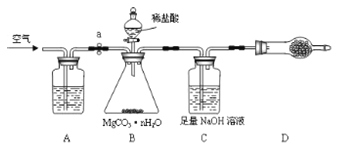
(3)裝置A中盛放的溶液是_____________。裝置D中盛放的固體是___________________,其作用是_________________________________。
(4)若三次實驗測得每1.000g碳酸鎂晶須產生的CO2平均值為a mol,則n值為__________________(用含a的代數式表達)。
(5)下列選項中,會造成實驗結果偏大的是____________。 (選填序號)
①實驗開始,未先通空氣,即稱量裝置C; ②B中反應結束后,沒有繼續通空氣;
③缺少裝置A; ④缺少裝置D;
⑤裝置B中稀鹽酸的滴加速率過快; ⑥裝置C中的NaOH溶液濃度過大。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KNO3固體樣品中含有少量的KCl、BaCl2雜質,為了提純KNO3并分離得到BaCl2,進行如下實驗操作:
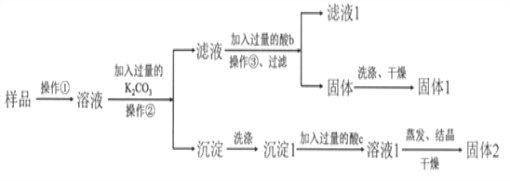
(1)試劑c的化學式是__________,固體1的化學式是__________。加入過量K2CO3所發生反應的化學方程式為________________________________。
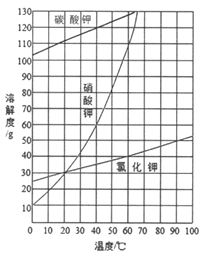
(2)結合下圖各物質的溶解度曲線可知操作③的名稱是_______、________。
(3)有同學認為操作③之前無需加入過量的酸b,也能得到純凈的固體1,你認為該同學的觀點是否正確?_____;并做出相應解釋___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的C/Na4Fe(CN)6--鈉離子電池是一種新型電池。下列有關說法正確的是
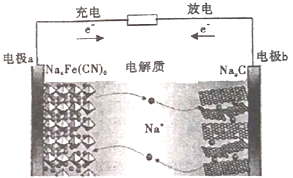
A. 電極a在放電時做正極,充電時做陰極
B. 放電時,電極b上的電極反應為:NaxC-e-=Na++Nax-1C
C. 電池工作時,Na+向電板b移動
D. 該電池通過Na+的定向移動產生電流,不發生氧化還原反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com