
【題目】向2L的密閉容器中充入7.6mol NO和3.8mol O2,發生如下反應:
①2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
②2NO2(g)![]() N2O4(g)
N2O4(g)
測得NO2和N2O4的濃度變化如圖所示,0~10min維持容器溫度為T1℃,10min后升高并維持容器的溫度為T2℃。下列說法正確的是

A. 前5min的平均反應速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃時反應②的化學平衡常數K=0.6
C. 反應①、②均為吸熱反應
D. 若起始時向該容器中充入3.6mol NO2和2.0mol N2O4,T1℃達到平衡時,N2O4的轉化率為10%
【答案】D
【解析】
試題A、根據圖像可知前5min內生成N2O4的濃度是0.9mol/L,則反應的平均速率v(N2O4)=0.9mol/L÷5min=0.18mol·L-1·min-1,A錯誤;B、T1℃時反應②平衡時N2O4的濃度是0.9mol/L,NO2的濃度是1.5mol/L,則反應②的化學平衡常數K=![]() ,B錯誤;C、10min后升高并維持容器的溫度為T2℃,此時N2O4的濃度降低,NO2的濃度升高,這說明反應②是放熱反應。N2O4濃度減少0.2mol/L,但NO2濃度只增加0.1mol/L,這說明反應①升高溫度后平衡向逆反應方向進行,即正方應也是放熱反應,C錯誤;D、若起始時向該容器中充入3.6mol NO2和2. 0mol N2O4,則根據方程式可知相當于起始時加入了7.6mol NO和3.8mol O2,,所以平衡是等效的,則T1℃達到平衡時,N2O4的物質的量是0.9mol/L×2=1.8mol,即消耗0.2molN2O4,所以N2O4的轉化率為10%,D正確,答案選D。
,B錯誤;C、10min后升高并維持容器的溫度為T2℃,此時N2O4的濃度降低,NO2的濃度升高,這說明反應②是放熱反應。N2O4濃度減少0.2mol/L,但NO2濃度只增加0.1mol/L,這說明反應①升高溫度后平衡向逆反應方向進行,即正方應也是放熱反應,C錯誤;D、若起始時向該容器中充入3.6mol NO2和2. 0mol N2O4,則根據方程式可知相當于起始時加入了7.6mol NO和3.8mol O2,,所以平衡是等效的,則T1℃達到平衡時,N2O4的物質的量是0.9mol/L×2=1.8mol,即消耗0.2molN2O4,所以N2O4的轉化率為10%,D正確,答案選D。


 智趣寒假作業云南科技出版社系列答案
智趣寒假作業云南科技出版社系列答案科目:高中化學 來源: 題型:
【題目】向體積為V L的恒容容器中加入0.3molA、0.1molC和一定量(未知)的B三種氣體,一定條件下發生反應,各物質濃度隨時間變化如下圖所示。已知在反應過程中混合氣體的總的物質的量沒有變化。請回答:
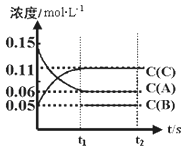
(1)V =_________。
(2)若t1=15s時,則0-t1階段以C物質濃度變化表示的反應速率v(C)=__________。
(3)寫出反應的化學方程式:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 某試樣焰色反應呈黃色,則試樣中含有K+
B. 用廣泛pH試紙測得NaClO溶液的pH值為12
C. 可用酒精代替CCl4萃取碘水中的碘單質
D. 金屬鎂失火不可用水來滅火
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】各式各樣電池的迅速發展是化學對人類的一項重大貢獻。下列有關電池的敘述正確的是()
A.手機上用的鋰離子電池屬于一次電池。B.鋅錳干電池中,鋅電極是負極
C.氫氧燃料電池工作時氫氣在負極上被還原D.太陽能電池的主要材料是高純度的二氧化硅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E是位于短周期的主族元素。已知:A、B、C、E在同一周期,在該周期元素中,A的原子半徑最大,B的離子半徑最小; A與B質子數之和是D質子數的3倍;C m- 、E (m-1)- 具有相同的電子層結構;熱穩定性:H m D>H m C。依據上述信息用相應的化學用語回答下列問題:
(1)H m D m 的電子式為____________________
(2)C m- 、E (m-1)- 的還原性強弱順序為:_________,(用離子符號表示)能證明其還原性強弱的離子方程式為________________________________。
(3)B單質與A的最高價氧化物對應水化物反應的化學方程式為:______________________。
(4)常溫下,將CD m 通入H m C溶液中,有C析出,寫出該過程的化學方程式__________________ 。
(5)在A、B、C、E單質中,符合下列轉化關系的是___________(填元素符號)。![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D四種化合物,有的是藥物,有的是香料。它們的結構簡式如下所示:
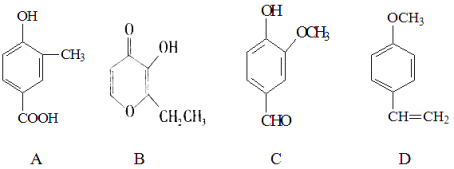
(1)化合物A的分子式是 ;A中含有的官能團的名稱是 、
(2)A、B、C、D四種化合物中互為同分異構體的是(填序號) ;
(3)化合物B的核磁共振氫譜中出現 組峰;
(4)1mol D最多能與 mol的氫氣發生加成反應;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如圖所示:
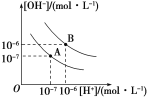
(1)若以A點表示25 ℃時水電離平衡時的離子濃度,當溫度上升到100 ℃時,水的電離平衡狀態到B點,則此時水的離子積從________增加到________。
(2)將pH=8的氫氧化鋇溶液與pH=5的鹽酸溶液混合并保持100 ℃恒溫,欲使混合溶液的pH=7,則氫氧化鋇溶液與鹽酸的體積比為________。
(3)已知AnBm的離子積K=[Am+]n·[Bn-]m,在某溫度下,氫氧化鈣溶解度為0.74 g,其飽和溶液密度設為1 g·cm-3,其離子積為K=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家設計出質子膜H2S燃料電池,實現了利用H2S廢氣資源回收能量并得到單質硫。質子膜H2S燃料電池的結構示意圖如圖所示。下列說法不正確的是( )
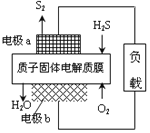
A. 電極a為電池的負極
B. 電極b上發生的電極反應為:O2+4H++4e-═2H2O
C. 電路中每流過2mol電子,在正極消耗22.4L H2S
D. 每34g H2S參與反應,有2mol H+經質子膜進入正極區
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com