
【題目】硫氰酸鹽、苯酚及硫代硫酸鹽是HPF脫硫廢液中的主要污染物(其中還含有Cl-、SO![]() 、Na+等),可用NaClO3、H2SO4作脫除的試劑。
、Na+等),可用NaClO3、H2SO4作脫除的試劑。
(1)Cl2與熱的NaOH溶液反應生成NaClO3,該反應的化學方程式為____________________________。
(2) 常溫時,反應C6H5O-+H2O ![]() C6H5OH+OH-的平衡常數為K=________(C6H5OH的Ka=1×10-10)。
C6H5OH+OH-的平衡常數為K=________(C6H5OH的Ka=1×10-10)。
(3)處理該廢水需經預處理和再處理階段。
①用濃硫酸對600 mL HPF脫硫廢液進行酸化預處理(反應溫度100℃),其結果如表1所示:
表1 預處理前后三種離子濃度變化情況
項目 | S2O | SCN-(g·L-1) | 苯酚(g·L-1) | pH |
處理前 | 34.28 | 70.11 | 1.3 | 8.55 |
處理后 | 0.91 | 69.76 | 1.35 | 2.4 |
由表1可知,該處理過程中主要被除去的污染物是________。
②對預處理后廢液進行再處理(反應溫度100 ℃)時,13次依次向廢液中加入試劑情況如表2所示:
表2 13次依次加入試劑情況
次數 | 1 | 2 | 3 | 4 | span>5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
NaClO3/g | 16.3 | 0 | 0 | 0 | 0 | 0 | 7.6 | 0 | 5.7 | 0 | 10.9 | 0 | 7.1 |
濃H2SO4/mL | 0 | 2 | 2 | 2 | 4 | 4 | 0 | 4 | 0 | 4 | 0 | 4 | 0 |
實驗結果如圖1所示:
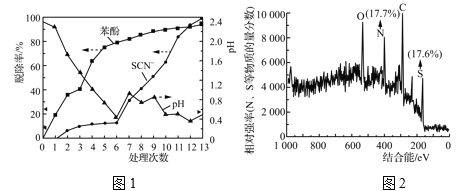
前![]() 和Cl-反應產生Cl2有關。該白色沉淀可能的結構簡式為______________。
和Cl-反應產生Cl2有關。該白色沉淀可能的結構簡式為______________。
③由表2和圖1中數據得出,第7~13次操作中SCN-在較強酸性條件下被ClO![]() (不水解)氧化的依據是________。此過程中產生大量磚紅色沉淀(夾雜少量白色沉淀),對沉淀進行XPS分析,部分元素的物質的量分數如圖2所示。已知SCN-可被某些氧化劑(如Cu2+等)最終氧化為磚紅色的沉淀(SCN)x。一種推測認為該實驗中產生的磚紅色沉淀為(SCN)x,支持該推測的證據有:________。
(不水解)氧化的依據是________。此過程中產生大量磚紅色沉淀(夾雜少量白色沉淀),對沉淀進行XPS分析,部分元素的物質的量分數如圖2所示。已知SCN-可被某些氧化劑(如Cu2+等)最終氧化為磚紅色的沉淀(SCN)x。一種推測認為該實驗中產生的磚紅色沉淀為(SCN)x,支持該推測的證據有:________。
【答案】 3Cl2 + 6NaOH![]() NaClO3+5NaCl+3H2O 1×10-4 S2O
NaClO3+5NaCl+3H2O 1×10-4 S2O![]() (硫代硫酸鹽) ClClOHCl(或ClOHCl、ClOH等 第7、9、11、13次加入NaClO3時,pH明顯增大,SCN-脫除率相應增大(或:7~13次加入NaClO3時SCN-脫除率明顯增大,而苯酚脫除率增大不明顯) SCN-可被某些氧化劑(如Cu2+等)氧化為磚紅色的沉淀,ClO
(硫代硫酸鹽) ClClOHCl(或ClOHCl、ClOH等 第7、9、11、13次加入NaClO3時,pH明顯增大,SCN-脫除率相應增大(或:7~13次加入NaClO3時SCN-脫除率明顯增大,而苯酚脫除率增大不明顯) SCN-可被某些氧化劑(如Cu2+等)氧化為磚紅色的沉淀,ClO![]() 具有較強的氧化性,SCN-也可被ClO
具有較強的氧化性,SCN-也可被ClO![]() 氧化,沉淀中N、S物質的量之比幾乎為1∶1且還含C
氧化,沉淀中N、S物質的量之比幾乎為1∶1且還含C
【解析】(1)依題意可得Cl2與熱的NaOH 溶液反應的化學方程式為3Cl2+6NaOHNaClO3+ 5NaCl+3H2O;
(2)已知C6H5OH的Ka=1×10-10,則反應C6H5O-+H2O![]() C6H5OH+OH -的平衡常數為K=
C6H5OH+OH -的平衡常數為K=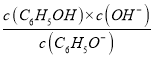 =
= 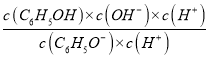 =
= ![]() = 1×10-4;
= 1×10-4;
(3) ①由表-1數據的變化可知,該處理過程中主要被除去的污染物是S2O32-(硫代硫酸鹽);②溶液中ClO3-和Cl-反應產生的Cl2能與苯酚反應生成三氯苯酚白色沉淀,其結構簡式為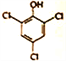 ;③由圖1可知,隨NaClO3加入,pH增大,SCN-脫除率明顯增大,而苯酚脫除率增大不明顯,所以SCN-在較強酸性條件下被ClO3-氧化了;由題目敘述可知SCN-可被某些氧化劑(如Cu2+等)氧化為磚紅色的沉淀,ClO3-具有較強的氧化性,由圖象2可知沉淀中N、S物質的量之比幾乎為1∶1,且還含有C元素,所以該實驗中產生的磚紅色沉淀為(SCN)x。
;③由圖1可知,隨NaClO3加入,pH增大,SCN-脫除率明顯增大,而苯酚脫除率增大不明顯,所以SCN-在較強酸性條件下被ClO3-氧化了;由題目敘述可知SCN-可被某些氧化劑(如Cu2+等)氧化為磚紅色的沉淀,ClO3-具有較強的氧化性,由圖象2可知沉淀中N、S物質的量之比幾乎為1∶1,且還含有C元素,所以該實驗中產生的磚紅色沉淀為(SCN)x。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】一種鋰銅可充電電池,工作原理如圖。在該電池中,非水系電解液和水系電解液被鋰離子固體電解質陶瓷片(LISICON)隔開。下列說法不正確的是
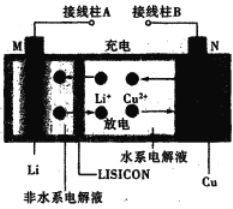
A. 陶瓷片允許Li+通過,不允許水分子通過
B. 放電時,N為電池的正極
C. 充電時,陰極反應為:Li+ +e-=Li
D. 充電時,接線柱A應與外接電源的正極相連
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是( )
A. 無色透明溶液中: Ca2+、Cu2+、Br-、Cl-
B. 能使酚酞變紅的溶液中: K+、Na+、CO![]() 、AlO
、AlO![]()
C. c(ClO-)=1mol·L-1的溶液中: Fe2+、Al3+、NO![]() 、I-
、I-
D. ![]() =0.1 mol·L-1的溶液中: NH
=0.1 mol·L-1的溶液中: NH![]() 、Mg2+、SO
、Mg2+、SO![]() 、CH3COO-
、CH3COO-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LED產品的使用為城市增添色彩。右圖是氫氧燃料電池驅動LED發光的一種裝置示意圖。下列有關敘述正確的是( )
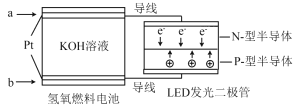
A. 該裝置將化學能最終轉化為電能
B. b處為電池正極,發生還原反應
C. a處通入O2
D. 通入O2的電極上發生的電極反應為O2 +4H+ +4e–=2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸錳銨晶體可用作織物和木材加工的防火劑等。由二氧化錳等作原料制取硫酸錳銨晶體步驟如下:
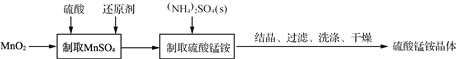
(1)實驗前,需稱量MnO2的質量,這是因為____________________________。
(2) “制取MnSO4”時,可用C6H12O6(葡萄糖)、H2C2O4(草酸)等物質作還原劑。
①用C6H12O6作還原劑(被氧化為CO2)時,發生反應的n(MnO2)/n(C6H12O6)=________。
②用H2C2O4作還原劑,發生反應的化學方程式為____________________________。
(3)一種測定硫酸錳銨晶體[設為: (NH4)xMny(SO4)z·wH2O]組成的方法如下:
①稱取一定量的硫酸錳銨晶體配成250 mL溶液A。
②取25.00 mL溶液A加入足量的BaCl2溶液得BaSO4 0.512 6 g。
③另取25.00 mL溶液A加入10 mL 20%的中性甲醛溶液,搖勻、靜置5 min[4NH![]() +6HCHO===3H++6H2O+(CH2)6N4H+,滴定時,1 mol(CH2)6N4H+與1 mol H+相當],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH標準溶液滴定至終點(在該過程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
+6HCHO===3H++6H2O+(CH2)6N4H+,滴定時,1 mol(CH2)6N4H+與1 mol H+相當],加入1~2滴酚酞溶液,用0.100 0 mol·L-1 NaOH標準溶液滴定至終點(在該過程中Mn2+不沉淀),消耗NaOH溶液22.00 mL。
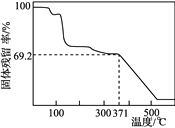
④取一定量樣品在空氣中加熱,樣品的固體殘留率(固體樣品的剩余質量/固體樣品的起始質量×100%)隨溫度的變化如右圖所示(樣品在371 ℃時已完全失去結晶水)。根據以上實驗數據計算確定硫酸錳銨晶體的化學式(寫出計算過程)。__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生物柴油是一種用植物油、動物油或廢棄油脂等為原料加工而成的清潔燃料,主要成分為高級脂肪酸甲酯。一種用菜籽油等為原料制備生物柴油的實驗步驟如下:
①向右圖所示的三口燒瓶中加入3.2 g CH3OH、0.2 g NaOH,溶解后向其中加入20 g(0.021~0.023 mol)菜籽油及60 mL正己烷。

②加熱至60~65 ℃,攪拌2.5~3 h,靜置。上層為生物柴油、正己烷及甲醇,下層主要為甘油。
③分液、水洗。
④蒸餾,保持120℃時至無液體流出,剩余物為生物柴油。
(1)步驟①中控制n(CH3OH)/n(油脂)>3的目的是________;正己烷的作用是________。
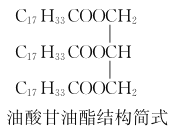
(2)步驟②適宜的加熱方式是________;菜籽油的成分之一油酸甘油酯(結構簡式如右圖)與甲醇反應的化學方程式為________________________________________________。
(3)步驟③用分液漏斗分離時,獲取上層液體的方法是________;用水洗滌上層液體時,說明已洗滌干凈的依據是__________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組離子在同一溶液中一定能大量共存的是( )
A. 含大量Ba2+的溶液中:Cl-、K+、SO![]() 、CO
、CO![]()
B. 含大量H+的溶液中:Mg2+、Na+、CO![]() 、SO
、SO![]()
C. 含大量OH-的溶液中:K+、NO、SO![]() 、Cu2+
、Cu2+
D. 含大量Na+的溶液中:H+、K+、SO![]() 、NO
、NO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.增大反應物濃度可增大活化分子百分數,所以反應速率增大
B.放熱反應的反應速率一定大于吸熱反應的反應速率
C.反應NH3(g) + HCl(g)![]() NH4Cl(s)在室溫下可自發進行,則該反應的△H<0
NH4Cl(s)在室溫下可自發進行,則該反應的△H<0
D.對于反應X(s)+aY(g)![]() bZ(g)+W(g) △H>0,升高溫度,正反應速率增大,逆反應速率減小
bZ(g)+W(g) △H>0,升高溫度,正反應速率增大,逆反應速率減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列事實不能用勒夏特列原理解釋的是( )
A. FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡體系中加入少量KSCN固體,溶液顏色加深
Fe(SCN)3+3KCl平衡體系中加入少量KSCN固體,溶液顏色加深
B. 工業合成氨中,將氨氣液化分離
C. A、B兩支試管中分別加入等體積5%的H2O2溶液,在B試管中加入2~3滴FeCl3溶液,B中試管中產生氣泡快
D. 對于反應2NO2(g)![]() N2O4(g) △H<0,升高溫度可使體系顏色變深
N2O4(g) △H<0,升高溫度可使體系顏色變深
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com