
【題目】下列與金屬腐蝕有關的說法,正確的是( )
A.圖1中,插入海水中的鐵棒,越靠近底端腐蝕越嚴重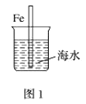
B.圖2中,插入溶液中的鐵棒容易溶解,主要是發生電化學腐蝕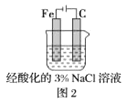
C.圖3中,燃氣灶的中心部位容易生銹,主要是由于高溫下鐵發生電化學腐蝕
D.圖4中,用犧牲鎂塊的方法來防止地下鋼鐵管道的腐蝕,鎂塊相當于原電池的負極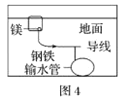
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】常溫下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1CH3COOH溶液的滴定曲線如圖所示。下列說法正確的是

A. 點①所示溶液中:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
B. 點②所示溶液中:c(Na+)+c(H+)=c(CH3COO-) +c(CH3COOH) +c(OH-)
C. 點③所示溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 在整個滴定過程中:溶液中![]() 始終不變
始終不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對傘花烴(a)常用作染料、醫藥、香料的中間體,a可轉化為b(如圖)。下列說法錯誤的是( )

A.常溫下對傘花烴呈液態且難溶于水
B.b物質的一氯代物有5種
C.對傘花烴分子中最多有9個碳原子共平面
D.圖中氫化反應既是加成反應也是還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的有( )
A.第四周期元素中,錳原子價電子層中未成對電子數最多
B.第二周期主族元素的原子半徑隨核電荷數增大依次減小
C.鹵素氫化物中,![]() 的沸點最低的原因是其分子間的范德華力最小
的沸點最低的原因是其分子間的范德華力最小
D.價層電子對互斥理論中,π鍵電子對數不計入中心原子的價層電子對數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列反應可用于檢測司機是否酒后駕駛:![]()
![]() 。
。
①配合物![]() 中,與
中,與![]() 形成配位鍵的原子是__________(填元素符號)。
形成配位鍵的原子是__________(填元素符號)。
②![]() 中
中![]() 原子的雜化軌道類型是________;
原子的雜化軌道類型是________;![]()
![]() 含有
含有![]() 鍵的數目為_______。
鍵的數目為_______。
(2)![]() 分子中,
分子中,![]() 原子的雜化軌道類型是__________;寫出由3個原子組成且與
原子的雜化軌道類型是__________;寫出由3個原子組成且與![]() 具有相同空間構型的離子:___________(填一個即可)。
具有相同空間構型的離子:___________(填一個即可)。
(3)石墨烯(結構如圖1所示)是一種由單層碳原子構成的具有平面結構的新型碳材料,石墨烯中部分碳原子被氧化后,其平面結構會發生改變,轉化為氧化石墨烯(結構如圖2所示)。

氧化石墨烯中2號![]() 原子的雜化方式是_________,該
原子的雜化方式是_________,該![]() 原子與相鄰
原子與相鄰![]() 原子形成的鍵角______(填“>”“<”或“=”)石墨烯中1號
原子形成的鍵角______(填“>”“<”或“=”)石墨烯中1號![]() 與相鄰
與相鄰![]() 形成的鍵角。
形成的鍵角。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是電解飽和 NaCl 溶液的實驗裝置,x、y 都是惰性電極,a 是飽和 NaCl 溶液,同時在兩邊各滴入幾滴酚酞試液,下列有關該實驗正確的說法是

A.x 電極為陽極,y 電極為陰極
B.x 電極附近溶液變紅色,且有刺激性氣味氣體產生
C.若將兩電極產生的氣體收集起來,X電極得到的氣體與Y電極得到的氣體之比之比略大于 1:1
D.電解后,將溶液混勻,電解前后溶液的 pH 未發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A(g)+B(g)![]() C(g)+D(g)反應的平衡常數和溫度的關系如下:
C(g)+D(g)反應的平衡常數和溫度的關系如下:
溫度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常數 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列問題:
(1)該反應的平衡常數表達式K=___,ΔH___0(填“<”“>”或“=”)。
(2)830℃時,向一個5L的密閉容器中充入0.20mol的A和0.80mol的B,如反應初始6s內A的平均反應速率v(A)=0.003molL-1s-1,則6s時c(A)=___molL-1,C的物質的量為___mol;若反應經一段時間后,達到平衡時A的轉化率為___,如果這時向該密閉容器中再充入1mol氬氣,平衡時A的轉化率為___。
(3)一定溫度下,能判斷該反應達化學平衡狀態的是___。
①單位時間內生成nmolA,同時消耗nmolC
②A的轉化率不變
③容器內壓強不再變化
④混合氣體的密度不再變化
⑤混合氣體的平均相對分子質量不再變化
(4)1200℃時,C(g)+D(g)![]() A(g)+B(g)的平衡常數的值為___。
A(g)+B(g)的平衡常數的值為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究高效催化劑是解決汽車尾氣中的 NO 和 CO 對大氣污染的重要途徑。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
則汽車尾氣的催化轉化反應 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃時,在分別裝有催化劑 A 和 B 的兩個容積為 2 L 的剛性密閉容器中,各充入物質的量均為nmol的NO和CO發生上述反應。通過測定容器內總壓強隨時間變化來探究催化劑對反應速率的影響,數據如下表:
時間/min | 0 | 10 | 20 | 30 | ∞ |
A容器內壓強/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器內壓強/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判斷催化劑 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡轉化率為 __________。400℃時,用壓強表示的平衡常數Kp__________(kPa)-1 (保留兩位小數)。
③汽車尾氣排氣管中使用催化劑可以提高污染物轉化率,其原因是 __________。
(3)為研究氣缸中NO的生成, 在體積可變的恒壓密閉容器中,高溫下充入物質的量均為 1mol 的氮氣和氧氣,發生反應 N2(g)+ O2(g)2NO(g)。
①下列說法能表明該反應已經達到平衡狀態的是_________(填序號)。
A.2v正(O2)= v逆(NO) B.混合氣體的平均相對分子質量不變
C.c(N2):c(O2)=l D.容器內溫度不變
②為減小平衡混合氣中 NO 的體積分數, 可采取的措施是 ___________。
(4)對于缸中NO的生成,化學家提出了如下反應歷程:
第一步 O22O 慢反應
第二步 O+N2NO+N 較快平衡
第三步 N+O2NO+O 快速平衡
下列說法錯誤的是_______(填標號)。
A.第一步反應不從N2分解開始,是因為N2比O2穩定
B.N、O 原子均為該反應的催化劑
C.三步反應中第一步反應活化能最大
D.三步反應的速率都隨溫度升高而增大
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com