
【題目】2017年2月19日在第十三屆阿布扎比國際防務展上,采用先進的氫燃料電池系統的無人機,創造了該級別270分鐘續航的新世界記錄。下列有關氫燃料電池的說法不正確的是
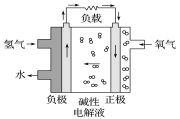
A. 通入氫氣的電極發生氧化反應
B. 堿性電解液中陽離子向通入氫氣的方向移動
C. 正極的電極反應式為O2+2H2O+4e-===4OH-
D. 放電過程中堿性電解液的OH-的物質的量不變
【答案】B
【解析】
氫氧燃料電池工作時,是把化學能轉變為電能,通入氫氣的一極為電源的負極,發生氧化反應,電極反應式為H2-2e-+2OH-═2H2O,通入氧氣的一極為原電池的正極,電極反應式為O2+2H2O+4e-═4OH-,陽離子向正極移動。
A. 該電池工作時化學能轉化為電能,通入氫氣的一極為電源的負極,發生氧化反應,A項正確;
B. 陽離子向正極移動即通入氧氣的一極移動,B項錯誤;
C. 通入氧氣的一極為原電池的正極,電極反應式為O2+2H2O+4e-===4OH-,C項正確;
D. 由圖可知,氫氧燃料電池放電過程中,總反應為氫氣和氧氣反應生成水,則堿性電解液中氫氧根的物質的量不變,D項正確;
答案選B。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(1)MgCl2·6NH3所含元素的簡單離子半徑由小到大的順序(H除外):____,所含元素的原子半徑由小到大的順序:_____,Mg在元素周期表中的位置:_______,Mg(OH)2的電子式:_____
(2)在NaCl、NaOH、N2、H2S中,只含有離子鍵的是____,僅含有共價鍵的化合物是_______
(3)用電子式表示MgCl2的形成過程___________
(4)將鋅片和銀片浸入稀硫酸中組成原電池,若該電池中兩電極的總質量為60g,工作一段時間后,取出鋅片和銀片洗凈,干燥后稱重,總質量為47g,則產生氫氣的體積___mL(標準狀況)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表短周期的一部分:

請按要求用化學用語回答下列問題:
(1)元素④、⑥、⑨的離子半徑由大到小的順序為________________;
(2)元素②、③、④的簡單氫化物的沸點由低到高的順序: _____________________;
(3)用電子式表示元素④與元素⑥形成的化合物的形成過程____________;
(4)比元素⑦的原子序數多17的元素在周期表的位置為________________;
(5)寫出由①④⑤三種元素組成的一種離子化合物的電子式_______________,若將其溶于水,破壞了其中的__________(填“離子鍵”、“共價鍵”或“離子鍵和共價鍵”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均為18電子分子,請寫出這兩種化合物按物質的量之比4:1反應的離子方程式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.髙錳酸鉀在實驗室和工農業生產中有廣泛的用途,實驗室以二氧化錳為主要原料制備高錳酸鉀,其部分流程如下:

(1)第①步加熱熔融應在鐵坩堝中進行,而不用瓷坩堝的原因是_______________________________(用化學方程式表示)。
(2)第④步通人適量CO2,發生反應生成MnO4-、MnO2和碳酸鹽,則發生反應的離子方程式為_______________________________。
(3)第⑥步加熱濃縮至液面有細小晶體析出時,停止加熱,冷卻結晶、過濾、洗滌、干燥,干燥過程中,溫度不宜過高,其原因是_________________(用化學方程式表)。
(4)H2O2和KMnO4都是常用的強氧化劑,若向H2O2溶液中滴加酸性髙錳酸鉀溶液,則酸性髙錳酸鉀溶液會褪色,寫出該反應的離子方程式: ________________________________。
II.某小組設計如圖所示的裝置圖(圖中夾持和加熱裝置略去),分別研究SO2和C12的性質。

(5)若從左端分別通入SO2和C12,裝置A中觀察到的現象是否相同______(填“相同”或“不相同”)。
(6)若裝置B中裝有5.0 mL 1.0 mol L-1的碘水,當通入足量Cl2完全反應后,共轉移了5. 0×10-2 mol電子,則該反應的化學方程式為____________________________。
(7)若由元素S和O組成-2價酸根離子X,X中S和O的質量比為4 : 3;當Cl2與含有X的溶液完全反應后,有淺黃色沉淀產生,取上層清液加人氯化鋇溶液,有白色沉淀產生。 寫出Cl2與含有X的溶液反應的離子方程式: __________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫、容積為2L的密閉容器中通入1 mol X和2 mol Y,發生反應:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末測得M的物質的量為0.4 mol。則下列說法正確的是
M(g) ΔH=-a kJ/mol(a>0),5 min末測得M的物質的量為0.4 mol。則下列說法正確的是
A. 0~5 min,X的平均反應速率為0.08 mol·L-1·min-1
B. 0~5 min,Y的平均反應速率為0.08 mol·L-1·min-1
C. 平衡后升高溫度,X的反應速率降低
D. 到達平衡狀態時,反應放出的熱量為a kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.NaNO2 因外觀和食鹽相似,又有咸味,容易使人誤食中毒。已知 NaNO2能發生反應:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反應中氧化劑是_____。
(2)根據上述反應,鑒別 NaNO2 和 NaCl。可選用的物質有①水、②碘化鉀淀粉試紙③淀粉、④白酒、⑤食醋,你認為必須選用的物質有_____(填序號)。
(3)請配平以下化學方程式:______
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH=
NaOH=![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反應過程中轉移 5 mol 電子,則生成標準狀況下 N2 的體積為_____L。
Ⅱ.“鋼是虎,釩是翼,鋼含釩猶如虎添翼”,釩是“現代工業的味精”。釩對稀酸是穩定的,但室溫下能溶解于濃硝酸中生成 VO2+。
(4)請寫出金屬釩與濃硝酸反應的離子方程式:_____。
(5)V2O5 是兩性氧化物,與強堿反應生成釩酸鹽(陰離子為 VO43-),溶于強酸生成含釩氧離子(VO2+)的鹽。請寫出 V2O5 分別與燒堿溶液和稀硫酸反應生成的鹽的化學式:_____、_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】F 是重要的有機化合物,可以由基礎化合物 A 通過以下過程制得:
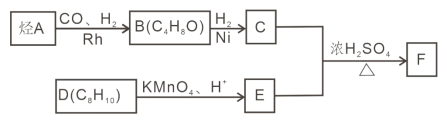
已知:①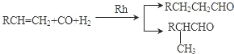
②核磁共振氫譜顯示 C 的分子中含有 4 種不同化學環境的氫原子,且其峰面積之比為6:1:2:1;
③F是酯類化合物,分子中苯環上的一溴取代物只有兩種。
(1)A 發生加聚反應的化學方程式是_____。
(2)B 物 質 的 名 稱 為 _____; 檢 驗 B 中 官 能 團 的 實 驗 操 作 方法___________。
(3)F 中的官能團的名稱為_____;C+E→F 的化學方程式是_____。
(4)X 與 E 互為同分異構體,且 X 具有下列性質,符合條件的 X 有_____種(不考慮立體異構)。
①分子中含有苯環,且能與 NaHCO3 溶液反應生成二氧化碳氣體
②與銀氨溶液共熱有銀鏡生成。
(5)設計由乙烯和必要的無機原料合成丙酸乙酯的合成路線_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素X、Y、W、Q在元素周期表中的相對位置如圖所示。常溫下,Al能溶于W的最高價氧化物對應水化物的稀溶液,卻不溶于其濃溶液。下列說法正確的是
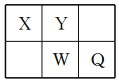
A. Y的最高化合價為+6
B. 簡單氫化物的穩定性:Y>W
C. 簡單離子半徑:W>Q>Y>X
D. X、Y、W不可能同時存在于一種離子化合物中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定質量的某有機物與足量金屬鈉反應,可得VAL氣體。相同質量的該有機物與適量的碳酸鈉濃溶液反應,可得VBL氣體。已知在同溫、同壓下VA和VB不相同,則該有機物可能是( )
A.CH2=CHCOOH
B.HOOC—COOH
C.CH3CH2COOH
D.HOOCCH2CH(OH)CH2COOH
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com