
【題目】對下列實驗過程的評價,正確的是( )
A. 某固體中加入稀鹽酸,產生了無色氣體,證明該固體中一定含有碳酸鹽
B. 某溶液中滴加BaCl2溶液,生成白色沉淀,證明一定含有SO![]()
C. 用萃取的方法分離汽油和煤油
D. 驗證燒堿溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,證明含Cl-
科目:高中化學 來源: 題型:
【題目】阿司匹林是一種解毒鎮(zhèn)痛藥。烴A是一種有機化工原料,下圖是以它為初始原料設計合成阿司匹林關系圖:
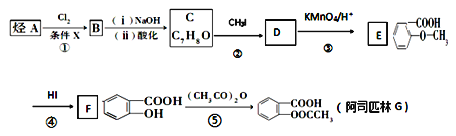
已知:①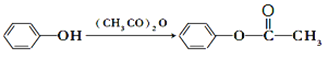
②烷基苯在高錳酸鉀的作用下,側鏈被氧化成羧基:![]()
③![]() (苯胺,易被氧化)
(苯胺,易被氧化)
請根據本題所給信息與所學知識回答下列問題:
(1)C的結構簡式為_______________。
(2)反應④的反應類型________,在③之前設計②這一步的目的是_____________。
(3)G(阿司匹林)與足量NaOH溶液反應的化學方程式為_____________________。
(4)符合下列條件的E的同分異構體有________種。寫出核磁共振氫譜中有四組峰,峰面積之比為3:2:2:1的結構簡式:________________(只寫一種)。
a.苯環(huán)上有兩個取代基
b.遇氯化鐵溶液顯紫色
c.能發(fā)生水解反應
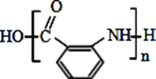
(5)利用甲苯為原料,結合以上合成路線和信息合成功能高分子材料(如圖,無機試劑任選)_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】5.1鎂鋁混合物放入足量氫氧化鈉溶液中充分反應后,生成氣體在標準狀況的體積為2.24L。
計算:(請寫詳細的計算步驟)
(1)混合物中含有鎂的質量為多少克____________?
(2)若反應完成后,溶液體積為50mL,則溶液中含鋁化合物的物質的量濃度為多少?______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A. [Ne]3s2表示的是Mg原子
B. 3p2表示第三能層有2個電子
C. 同一原子中,1s、2s、3s電子的能量逐漸減小
D. 2p、3p、4p能級容納的最多電子數依次增多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】夾緊下列裝置中的彈簧夾并進行相關操作。下列情形中,表明相應裝置漏氣的是( )
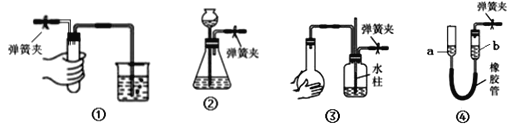
A. 裝置①中,用手捂住試管,燒杯中出現氣泡,放開手后,導管中形成一段穩(wěn)定的水柱
B. 裝置②中,向長頸漏斗中加入一定量水,形成水柱,隨后水柱下降至與瓶中液面相平的位置
C. 裝置③中,雙手捂住燒瓶,導管中形成一段穩(wěn)定的水柱,雙手放開后,水柱慢慢回落
D. 裝置④中,將a管向上提至一段高度,a、b兩管之間水面形成穩(wěn)定的高度差
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠色能源是指使用過程中不排放或排放極少污染物的能源,如一級能源中的水能、地熱能、天然氣等;二級能源中的電能、氫能等.下列能源屬于綠色能源的是( ) ①太陽能 ②風能 ③石油 ④煤 ⑤潮汐能.
A.①②③
B.③④⑤
C.②④⑤
D.①②⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為驗證鹵素單質氧化性的相對強弱,某小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)。
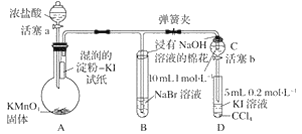
實驗過程:
Ⅰ.打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ.當B和C中的溶液都變?yōu)辄S色時,夾緊彈簧夾。
Ⅲ.當B中溶液由黃色變?yōu)樽丶t色時,關閉活塞a。
Ⅳ.……
(1)驗證氯氣的氧化性強于碘的實驗現象是_________________________________________。
(2)B中溶液發(fā)生反應的離子方程式是____________________________________________。
(3)為驗證溴的氧化性強于碘,過程Ⅳ的操作和現象是________________________________。
(4)過程Ⅲ實驗的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列原子半徑最小的是( )
A. 1s22s22p3 B. 1s22s22p33s23p3
C. 1s22s22p5 D. 1s22s22p33s23p2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合硫酸鐵(PFS) 是一種高效的無機高分子絮凝劑。某工廠利用經浮選的硫鐵礦燒渣 (有效成分為Fe2O3和Fe3O4) 制備PFS,其工藝流程如下圖所示。
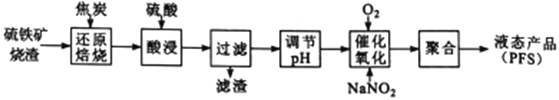
(1)“還原焙燒”過程中,CO還原Fe3O4生成FeO的熱化學方程式為___________________________。
已知:Fe3O4(s)+C(s)=3FeO(s)+CO(g) ΔH1= 191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g) =2CO(g) ΔH3= 172.5kJ·mol-1
(2)CO是“還原焙燒" 過程的主要還原劑。下圖中,曲線表示4個化學反應a、b、c、d達到平衡時氣相組成和溫度的關系,Ⅰ、Ⅱ、Ⅲ、Ⅳ分別是Fe2O3、Fe3O4、FeO、Fe穩(wěn)定存在的區(qū)域。a屬于_________(填“吸熱反應”或“放熱反應”);570℃時,d反應的平衡常數K=_________________。
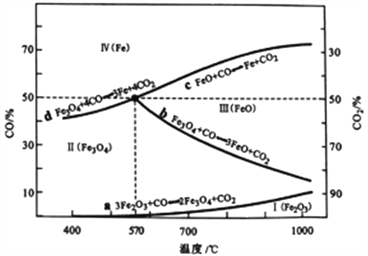
(3)工業(yè)上,“還原培燒”的溫度一般控制在800℃左右,溫度不宜過高的理由是____________________。
(4)若“酸浸”時間過長,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)已知:25℃時,Ksp[Fe(OH)2]=1.0×10-17, Ksp[Fe(OH)3]=1.0×10-39,若浸出液中c(Fe2+) =10-1.8mol·L-1,為避免“催化氧化”過程中產生Fe(OH)3,應調節(jié)浸出液的pH≤_____________。
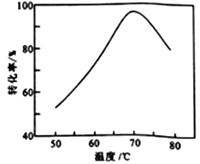
(6)FeSO4溶液在空氣中會緩慢氧化生成難溶的Fe(OH)SO4,該反應的離子方程式為_________________________。“催化氧化”過程用NaNO2作催化劑(NO起實質上的催化作用)時,溫度與Fe2+轉化率的關系如右圖所示(反應時間相同),Fe2+轉化率隨溫度的升高先上升后下降的原因是_______________________________。
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com