
【題目】莽草酸的一種異構體A在濃硫酸作用下加熱可得到B.下列說法不正確的是( )
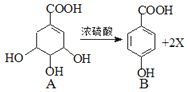
A. X的化學式為H20
B. A既能使![]() 溶液褪色,又能使酸性
溶液褪色,又能使酸性![]() 溶液褪色
溶液褪色
C. B所有碳原子在同一平面上
D. 與B分子式相同,有三個官能團且苯環上的一氯取代物有兩種的異構體只有一種
科目:高中化學 來源: 題型:
【題目】一種鋰離子電池的反應式為 LixC6 + Li1xCoO2![]() 6C+LiCoO2(x<1)。其工作原理如圖所示。下列說法不正確的是
6C+LiCoO2(x<1)。其工作原理如圖所示。下列說法不正確的是
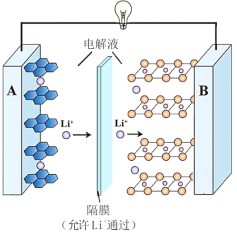
A.放電時,A 極電極式為:LixC6 xe = 6C + xLi+
B.放電時,若轉移 0.3 mol 電子,石墨電極將減重 2.1g
C.充電時,Li+從左向右移動
D.若要從廢舊該型鋰電池的正極材料中回收鋰元素,先進行放電處理,有利于 Li+盡可能從負極脫出,在正極富集
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4超干重整CO2技術可得到富含CO的化工原料。回答下列問題:
(1)CH4超干重整CO2的催化轉化如圖所示:
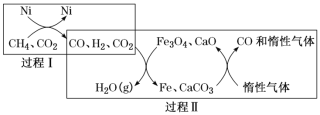
①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2kJ/mol ;
CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H2=-165kJ/mol;
過程I的熱化學方程式為_______。
②關于上述過程II的說法不正確的是______(填字母)。
a.實現了含碳物質與含氫物質的分離 b.可表示為CO2+H2H2O(g)+CO c.CO未參與反應 d.Fe3O4、CaO為催化劑,降低了反應的ΔH
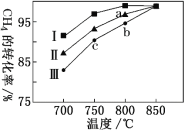
③其他條件不變,在不同催化劑(I、II、III)作用下,反應CH4(g)+CO2(g) 2CO(g)+2H2(g)進行相同時間后,CH4的轉化率隨反應溫度的變化如圖所示。a點是否達到平衡狀態?________(填“是”或“否”);b點CH4的轉化率高于c點,原因是________。
(2)在剛性密閉容器中,加入CH4和CO2,二者分壓分別為20 kPa、25 kPa,加入Ni/α-Al2O3催化劑并加熱至1123 K使其發生反應CH4(g)+CO2(g) 2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.3×10-2·p(CH4) ·p(CO2)。(單位忽略),某時刻測得p(CO)=20 kPa,則p(CO2)=________kPa,v(CO)=________(單位忽略)。
②達到平衡后測得體系壓強是起始時的1.8倍,則該反應的平衡常數的計算式為Kp=________。(用各物質的分壓計算)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)葡萄酒中SO2最大使用量為0.25g·L-1,取300.00mL葡萄酒,通過適當的方法使所含SO2全部逸出并用H2O2將其全部氧化為H2SO4,然后用0.0900mol·L-1NaOH標準溶液進行滴定。
①滴定前排氣泡時,應選擇如圖中的___(填序號)

②若用50mL滴定管進行實驗,當滴定管中的液面在刻度“10”處,則管內液體的體積___(填序號)。
①=10mL ②=40mL ③<10 mL ④>40 mL。
③上述滴定實驗中若滴定終點時溶液的pH=8.8,則選擇的指示劑為______,選擇該指示劑時如何判斷反應到達滴定終點:______。
④滴定至終點時,消耗NaOH溶液25.00mL,該葡萄酒中SO2含量為___g·L-1;滴定終點讀數時俯視刻度線,則測量結果比實際值______(填“偏高”、“偏低”或“無影響”)。
(2)某學生用0.100molL-1的KOH標準溶液滴定未知濃度的鹽酸,其操作為:
A.移取20mL待測鹽酸溶液注入潔凈的錐形瓶中,并加入2~3滴酚酞;
B.用標準溶液潤洗滴定管2~3次;
C.把盛有標準溶液的堿式滴定管固定好,調節滴定管使尖嘴處充滿溶液;
D.取標準KOH溶液注入堿式滴定管至刻度“0”以上2~3cm 處;
E.調節液面至“0”或“0”以下刻度,記下讀數;
F.把錐形瓶放在滴定管下面,用標準KOH溶液滴定至終點并記下刻度。
實驗編號 | KOH溶液的濃度(mol/L) | 滴定完成時,KOH溶液滴入的體積(mL) | 待測鹽酸溶液的體積(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正確操作步驟的順序是(用序號字母填寫)_________。
②根據上述數據,可計算出該鹽酸的濃度約為_______(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如下實驗方案,以分離KCl和BaCl2兩種固體混合物,試回答下列問題:

供選試劑:Na2SO4溶液、K2CO3溶液、K2SO4溶液、鹽酸
(1)操作①的名稱是________,操作②的名稱是____________。
(2)試劑a是____________(填化學式,下同),試劑b是__________,固體B是____________。
(3)加入試劑a所發生反應的化學方程式為__________________________________。
加入試劑b所發生反應的化學方程式為____________________________________。
(4)該方案能否達到實驗目的:__________________________(填“能”或“不能”)。若不能,應如何改進?(若能,此問不用回答)__________。
(5)若要測定原混合物中BaCl2的質量分數,除了要準確稱量混合物的質量外,至少還要獲得的數據是____的質量。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】GMA可用作涂料、離子交換樹脂和油墨的黏合劑等,通過酯交換反應制備,反應如下:
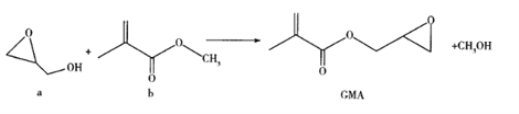
下列說法錯誤的是( )
A.與a互為同分異構體的羧酸只有1種
B.b分子中的所有C原子和O原子可能在同一平面內,含有三種官能團
C.GMA的分子式為C7H10O3
D.GMA能與NaOH溶液、溴水、酸性KMnO4溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA是阿伏加德羅常數的值,下列說法正確的是
A. 16.25gFeCl3水解形成的Fe(OH)3膠體粒子數為0.1NA
B. 標準狀況下,11.2 L甲烷和乙烯混合物中含氫原子數目為2NA
C. pH=1的H3PO4溶液中,含有0.1NA個H+
D. 10 g的D2O中含有的質子數與中子數分別為5NA和4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
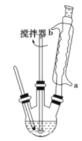
【題目】苯甲酸及其鈉鹽可用作乳膠、牙膏、果醬或其他食品的抑菌劑,也可廣泛應用于制藥和化工行業,某同學嘗試用甲苯的氧化反應制備苯甲酸。主要實驗裝置(回流攪拌裝置)如圖所示:
反應原理:
![]() +2KMnO4→
+2KMnO4→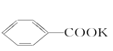 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
實驗方法:將一定量的甲苯和KMnO4溶液置于三頸燒瓶中,在90℃時反應一段時間后,停止反應,按如圖流程分離出苯甲酸并回收未反應的甲苯。
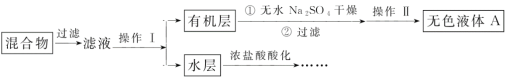
(1)無色液體A的結構簡式為___,操作Ⅱ為___;
(2)如果濾液呈紫色,要先加飽和亞硫酸鉀溶液,過濾后再進行操作Ⅰ。加飽和亞硫酸鉀溶液的目的是___,寫出該反應的離子方程式:___;
(3)冷卻水應該從冷凝管___(填“a”或“b”)口流入;
(4)要由“水層”得到苯甲酸晶體,應進行下列操作,正確的操作順序是___(填選項字母):
A.酸化 B.過濾 C.蒸發濃縮 D.冷卻結晶
(5)純度測定:稱取1.22g產品,配成100mL溶液,取其中25.00mL溶液,用KOH溶液進行滴定,消耗KOH的物質的量為2.40×10-3mol,則產品中苯甲酸的質量分數為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)25℃時,現有pH=2的HCl溶液100mL,要使它的pH=3,如果加入蒸餾水,需加水______________mL;如果加入pH=4的HCl溶液,需加入此HCl溶液_____________mL。(假定溶液體積有加和性,下同)
(2)25℃時,將pH=8的NaOH溶液與pH=13的NaOH溶液等體積混合后,溶液的pH=________________。(lg2=0.3)
(3)25℃時,將0.1mol·L-1鹽酸和0.06mol·L-1氫氧化鋇溶液等體積混合后,該混合溶液的pH=___________。
(4)25℃時,pH=a的X體積的某強酸與pH=b的Y體積的某強堿混合后,溶液呈中性,已知a+b=15,則X:Y=_____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com