
【題目】某舊電器的金屬部件中Zn、Fe、Cu、Ag等金屬單質,與足量稀鹽酸反應后過濾,剩余固體中不可能含有
A. FeB. Zn
C. CuD. Ag
科目:高中化學 來源: 題型:
【題目】(題文)近年來,研究人員提出利用含硫物質熱化學循環實現太陽能的轉化與存儲。過程如下:

(1)反應Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反應Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反應Ⅱ的熱化學方程式:________________。
(2)對反應Ⅱ,在某一投料比時,兩種壓強下,H2SO4在平衡體系中物質的量分數隨溫度的變化關系如圖所示。

p2_______p 1(填“>”或“<”),得出該結論的理由是________________。
(3)I-可以作為水溶液中SO2歧化反應的催化劑,可能的催化過程如下。將ii補充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反應速率與SO2歧化反應速率的關系,實驗如下:分別將18 mL SO2飽和溶液加入到2 mL下列試劑中,密閉放置觀察現象。(已知:I2易溶解在KI溶液中)
序號 | A | B | C | D |
試劑組成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
實驗現象 | 溶液變黃,一段時間后出現渾濁 | 溶液變黃,出現渾濁較A快 | 無明顯現象 | 溶液由棕褐色很快褪色,變成黃色,出現渾濁較A快 |
①B是A的對比實驗,則a=__________。
②比較A、B、C,可得出的結論是______________________。
③實驗表明,SO2的歧化反應速率D>A,結合i、ii反應速率解釋原因:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組用如圖所示裝置進行實驗,探究鐵和濃硫酸反應的產物及性質。(夾持裝置已略,氣密性已檢驗)
實驗開始前,先打開活塞K通一段時間N2。關閉活塞K后,向A中滴加一定量的濃硫酸,加熱觀察到A中鐵片上有氣泡產生。
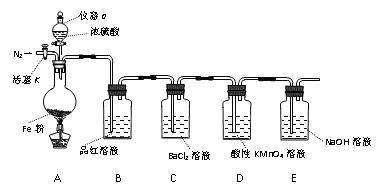
請回答下列問題:
(1)儀器a的名稱是____。實驗開始前,先通一段時間N2的目的是____。
(2)加熱一段時間后發現B裝置中溶液褪色,說明有____(填化學式)生成。再取出A中反應后的溶液少許,加入KSCN溶液未出現血紅色,濃硫酸與鐵反應的化學方程式是____。
(3)C裝置中____(填“有”或“無”)沉淀生成。D中溶液紫色褪去,體現氣體產物的____性(填“氧化”、“還原”或“漂白性”)。
(4)E裝置的作用是____。(用離子方程式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向Na2CO3溶液中滴入鹽酸,混合溶液的pH與離子濃度變化的關系如圖所示。

已知:lgX=lg![]() 或lg
或lg![]() ,下列敘述正確的是
,下列敘述正確的是
A. 曲線m表示pH與lg![]() 的變化關系
的變化關系
B. 當溶液呈中性時,c(Na+)=![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃時,CO32-+H2O![]()
![]() +OH-的平衡常數為1.0×10-7.6
+OH-的平衡常數為1.0×10-7.6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學在日常生活中用途廣泛,圖①是鎂-次氯酸鈉燃料電池,電池總反應為:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,圖②是Cr2O72-的工業廢水的處理。下列說法正確的是( )

A. 圖②中Cr2O72-離子向惰性電極移動,與該極附近的OH-結合轉化成Cr(OH)3除去
B. 圖②的電解池中,有0.084g陽極材料參與反應,陰極會有336mL的氣體產生(標況)
C. 圖①中發生的還原反應是:Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D. 若圖①中3.6g鎂溶解產生的電量用以圖②廢水處理,理論可產生10.7g氫氧化鐵沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從古至今,鐵及其化合物在人類生產生活中的作用發生了巨大改變。
Ⅰ.(1)鐵元素在周期表中的位置為___________。
(2)古代中國四大發明之一的指南針是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下圖是用硫鐵礦燒渣(主要成分為Fe2O3、Fe3O4、SiO2)為原料制備高純氧化鐵的生產流程示意圖:

回答下列問題:
(1)酸浸、過濾后濾液A中的金屬陽離子是 ___________ 。
(2)煅燒FeCO3生成產品Ⅰ的化學方程式為___________。
(3)已知幾種鹽的溶解度隨溫度變化的曲線如圖所示,產品Ⅱ的化學式為 ___________ 。

(4)寫出步驟Ⅳ反應的離子方程式:___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com