
【題目】下列說法正確的是( )
A. 《元豐行示德逢》里“雷蟠電掣云滔滔,夜半載雨輸亭皋”涉及化學反應N2+O2![]() 2NO
2NO
B. 檢驗久置 Na2SO3是否變質,可用BaCl2溶液和稀硝酸
C. SO2通入BaCl2溶液中會產生白色沉淀
D. 將銅片放入濃硫酸中,無明顯現象是因為銅片發生了鈍化
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】對于SO2和CO2的說法中正確的是( )
A. 都是直線形結構
B. 中心原子都采用SP雜化軌道
C. SO2為V形結構,CO2為直線形結構
D. S原子和C原子上都沒有孤對電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化錳是制造鋅錳干電池的基本材料,工業上以軟錳礦、菱錳礦為原料來制備。某軟錳礦主要成分為MnO2,還含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,其處理流程圖如下:

化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-35 | 10-6 | 10-38 |
(1)硫酸亞鐵在酸性條件下將MnO2還原為MnSO4,酸浸時發生的主要反應的化學方程式為______________________。
(2)“氨水、攪拌”,其中“攪拌”不僅能加快反應速率,還能___________;濾渣A的成分是Fe(OH)3、Al(OH)3,加入氨水需調節pH 至少達到____________,恰好能使Fe3+、A13+沉淀完全。(當離子濃度降到1.0×10-5mol·L-1時即視為沉淀完全)
(3)濾渣B的成分是___________________。
(4)MnO2也可在MnSO4-H2SO4-H2O為體系的電解液中電解獲得,其陽極電極反應式為_____________________________________________________。
(5)工業上采用間接氧化還原滴定法測定MnO2純度,其操作過程如下:準確稱量0.9200g該樣品,與足量酸性KI 溶液充分反應后,配制成100mL溶液。取其中20.00mL,恰好與25.00mL 0.0800mol·L-1Na2S2O3溶液反應(I2+2S2O32-=2I-+S4O62-)。計算可得該樣品純度_____%。(小數點后保留1位數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某地湖鹽中含有Ca2+、Mg2+、Fe3+、SO42-等雜質離子,氨堿廠用該地湖鹽制取燒堿。其中制得精制食鹽水的過程如下:

(1)過程Ⅰ中將粗鹽加水溶解需要適當加熱,其目的是__________。
(2)過程Ⅱ的目的是除去SO42-,加入的X溶液是__________。
(3)下表是過程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃時的溶解度[g/100gH2O]
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①過程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外還有__________。
②過程Ⅳ中調節pH時發生的主要反應的離子方程式為__________。
(4)上述精制食鹽水中還含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去這些離子及進行電解的流程如下:
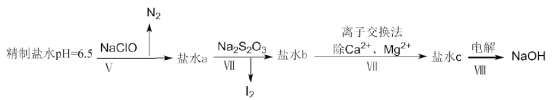
①過程V生成N2的離子方程式為__________。
②過程Ⅳ可以通過控制Na2S2O3的量,將IO3-還原成I2,且鹽水b中含有SO42-,該過程中發生氧化還原反應,其中氧化劑和還原劑的物質的量之比為__________。
③在過程Ⅳ中所用的Na2S2O3俗稱海波,是一種重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。為了測定其含Na2S2O3·5H2O的純度,稱取8.00g樣品,配成250mL溶液,取25.00mL于錐形瓶中,滴加淀粉溶液作指示劑,再用濃度為0.0500mol·L-1的碘水滴定(發生反應2S2O32-+I2=S4O62-+2I-),下表記錄滴定結果:
滴定次數 | 滴定前讀數(mL) | 滴定后讀數(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
計算樣品的純度為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~I分別表示中學化學中常見的一種物質,其中A、I為常見金屬,它們之間的相互關系如圖所示(部分反應物、生成物沒有列出),且已知G為主族元素的固態氧化物,A、B、C、D、E、F六種物質中均含同一種元素。請填寫下列空白:

(1)A、B、C、D、E、F六種物質中所含同一種元素在周期表中的位置是________。
(2)寫出C物質的化學式:________。
(3)寫出①、⑥反應的化學方程式:
①:____________________________。
⑥:____________________________。
(4)從能量變化的角度看,反應①②③中,屬于放熱反應的是________(填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某課外小組利用干燥純凈H2還原黃色的WO3粉末并測定W的相對原子質量,如圖是測定裝置的示意圖,A中的試劑是鹽酸。
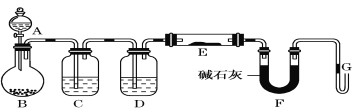
請回答下列問題。
(1)儀器B的名稱是_____________。
(2)連接好裝置后應首先檢查氣密性,其方法是____________________。
(3)檢查氣密性后,下列實驗操作的先后順序是(填字母)__________________。
a.加熱玻璃管 b.從A瓶逐滴滴加液體 c. A瓶停止滴加液體
d.停止加熱 e.檢驗氫氣純度
(4)已知取用WO3質量為a克,F的U形管實驗前后質量分別為b克、c克,則鎢的相對分子質量用字母表示為___________________________。
Ⅱ.探究AgNO3的熱穩定性
用下圖所示的實驗裝置A加熱AgNO3固體,產生紅棕色氣體NO2(可以被堿完全吸收),在裝置D中收集到無色氣體。當反應結束后,試管中殘留固體為黑色銀單質。
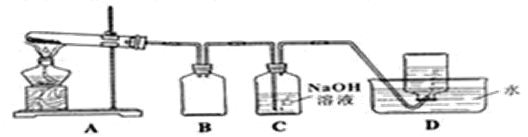
(5)給A中試管加熱的方法是____________________。
(6)沒有裝置B可能出現的現象___________________________。
(7)有同學提出可以把B、C換成一個簡單的裝置,你認為可以是____________。
(8)同學們根據氧化還原反應知識討論可以得出D中收集的氣體成分。用實驗證明該氣體的方法是______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學用含結晶水的正鹽X(四種短周期元素組成的純凈物)進行了如下實驗:
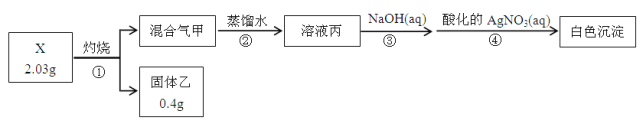
實驗中觀測到:混合氣甲呈無色并被蒸餾水全部吸收;固體乙為純凈物;在步驟③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH;另取一定量的溶液丙,加入少量K2FeO4固體,產生黃綠色氣體。
請回答:
(1)X的化學式是__________,步驟①的化學方程式是______________________________。
(2)溶液丙與K2FeO4固體反應的化學方程式是_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究小組按下列路線合成抗抑郁藥物嗎氯貝胺
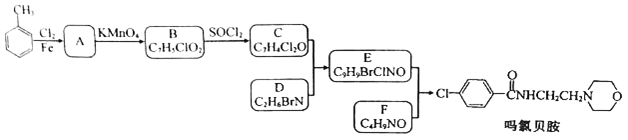
已知:
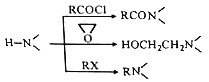
請回答:
(1)下列說法不正確的是________。
A. 化合物A能發生還原反應 B. 化合物B能與碳酸氫鈉反應產生氣體
C. 化合物D具有堿性 D. 嗎氯貝胺的化學式是C13H13ClN2O2
(2)化合物F的結構簡式是_____________。
(3)寫出C+D→E的化學方程式______________________。
(4)為探索新的合成路線,發現用化合物C與X(C6H14N2O)一步反應即可合成嗎氯貝胺。請設計以環氧乙烷(![]() )為原料合成X的合成路線___________(用流程圖表示,無機試劑任選)。
)為原料合成X的合成路線___________(用流程圖表示,無機試劑任選)。
(5)寫出化合物X(C6H14N2O)可能的同分異構體的結構簡式_____________。須同時符合:①分子中有一個六元環,且成環原子中最多含一個非碳原子。②1H-NMR譜顯示分子中有5種氫原子;IR譜表明分子中有N-N鍵,無 O-H鍵
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com