
【題目】下列有關原子結構與性質的說法正確的是( )
A.![]() 的基態原子的第一電離能依次遞增
的基態原子的第一電離能依次遞增
B.![]() 的基態電子排布式為
的基態電子排布式為![]()
C.![]() 有6種不同能量的電子
有6種不同能量的電子
D.化合物![]() 中S元素顯-2價,說明C元素比S元素的電負性弱
中S元素顯-2價,說明C元素比S元素的電負性弱
科目:高中化學 來源: 題型:
【題目】在同溫、同壓下,下列三個反應放出的熱量分別用a、b、c表示,則a、b、c的關系是( )
2H2(g)+O2(g)===2H2O(g) ΔH=-a kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH=-b kJ·mol-1 ②
H2(g)+1/2O2(g)===H2O(g) ΔH=-c kJ·mol-1 ③
A.a>b, b=2cB.a=b=cC.a<b,c=a/2D.無法比較
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿伏加德羅常數的值為NA,下列敘述中錯誤的是( )
①標準狀況下,2.24L水中含有0.1 NA個水分子
②常溫常壓下,32gSO2 含有的分子數約為3.01×1023
③2 molNaOH的摩爾質量為80g/mol
④H2的氣體摩爾體積約為22.4L/mol
⑤室溫下,32gO2和O3的混合氣體中含有的氧原子數為2NA
⑥2mol/L的CaCl2溶液中Cl-的數目為4NA
⑦常溫常壓下,1mol氦氣含有的原子數為NA
⑧11.2L氯氣中含有 NA個氯原子
⑨在標準狀況下,22.4L由N2和N2O組成的混合氣體中,所含有的氮原子的物質的量為2mol
⑩標準狀況下14gCO含有的核外電子數為10NA
A.①③④⑥⑧⑩B.①④⑤⑥⑧⑨
C.①②④⑥⑧⑨D.②③④⑤⑦⑩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將鋁粉和四氧化三鐵粉末混合成鋁熱劑,平均分成兩份。第一份在高溫下二者恰好完全反應將生成物與足量的鹽酸充分反應;第二份直接加入足量的氫氧化鈉溶液使之充分反應。前后兩種情況生成氣體的物質的量之比
A.1:1B.3:2C.2:3D.3:4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種中學常見物質之間的轉化關系如圖所示(部分反應條件已省略)。已知:E為常見金屬;在標準狀況下氣體R的密度為![]() 。下列推斷合理的是( )
。下列推斷合理的是( )
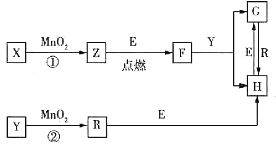
A.X—定是H2O2
B.![]() 在反應①②中都作催化劑
在反應①②中都作催化劑
C.常溫下,![]() 溶液的pH=2
溶液的pH=2
D.上述轉化涉及的反應都是氧化還原反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】揮發性有機物(VOCs)對環境易造成污染,VOCs催化燃燒處理技術具有凈化率高、燃燒溫度低、無明火、不會有 NOz等二次污染物產生等優點。圖甲是VOCs處理過程中固體催化劑的催化原理,圖乙是反應過程中的能量變化圖。下列敘述正確的是( )
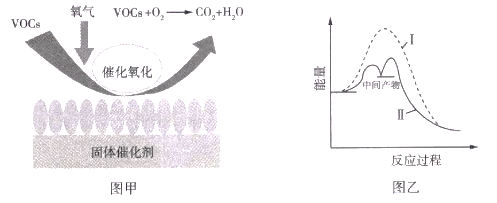
A.圖甲中固體催化劑表面既有化學鍵斷裂,也有化學鍵形成
B.圖甲中固體催化劑可提高VOCs的平衡轉化率
C.圖乙中曲線II使用了固體催化劑,反應活化能降低
D.VOCs催化氧化過程中所有反應均為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃和101kPa時,乙烷、乙炔和丙烯組成的混合烴20mL,與過量氧氣混合并完全燃燒,除去水蒸氣,恢復到原來的溫度和壓強,氣體總體積縮小了40mL,原混合烴中乙炔的體積分數為 ( )
A. 12.5%B. 25%C. 50%D. 75%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制取乙烯時,常因溫度過高而發生副反應,部分乙醇跟濃H2SO4 反應生成SO2,CO2,水蒸氣和炭黑。
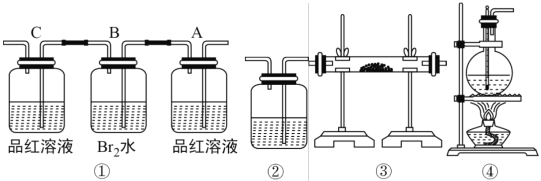
(1)用編號為①→④的實驗裝置設計一個實驗,以驗證上述反應混合氣體中含CO2,SO2和水蒸氣。寫出裝置的連接順序(按產物氣流從左到右的流向填寫編號):______。
(2)實驗的裝置①中 A 瓶的現象是______;結論為__________。 B 瓶中的現象是__________; B 瓶溶液作用為__________。若 C 瓶中品紅溶液不褪色,可得到結論為__________。
(3)裝置③中加的固體藥品是______以驗證混合氣體中有______。裝置②中盛的溶液是_____以驗證混合氣體中有______。
(4)簡述裝置①在整套裝置中位置的理由__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種制氫技術原理如圖所示。容器Ⅰ中發生的某反應a為C(s)+2H2O(g)![]() CO2(g)+2H2(g);ΔH。下列有關說法正確的是( )
CO2(g)+2H2(g);ΔH。下列有關說法正確的是( )
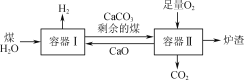
A.已知反應a在一定條件下能夠自發進行,則該反應的ΔH<0
B.向容器Ⅰ中加入CaO能有效實現H2與CO2的分離
C.剩余的煤進入容器Ⅱ是為了充分利用其與O2反應放出的熱量
D.煤中含有的S在容器Ⅱ中最終轉化為CaSO3進入爐渣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com