
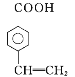
【題目】肉桂酸甲酯(H)常用作食用香精。用芳香烴A為原料先合成肉桂酸G(![]() ),繼而合成H的路線如下:
),繼而合成H的路線如下:

請回答下列問題:
(1)化合物A的結構簡式為___________。
(2)B→C所加試劑的名稱是______________,F→G的反應類型為__________。
(3)G→H的化學方程式為__________________。
(4)寫出與肉桂酸互為同分異構體,且能使溴的四氯化碳溶液褪色,還能與碳酸氫鈉溶液反應的所有同分異構體的結構簡式_________。
【答案】![]() NaOH水溶液 消去反應
NaOH水溶液 消去反應 ![]() +CH3OH
+CH3OH ![]()
![]() +H2O
+H2O ![]() 、
、 、
、 、
、
【解析】
C的不飽和度=(9×2+2-12)/2=4,C的不飽和度為4,結合D結構簡式知,C中含有一個苯環,C結構簡式為![]() ,B發生取代反應或水解反應生成C,B結構簡式為
,B發生取代反應或水解反應生成C,B結構簡式為![]() ,A發生加成反應生成B,A結構簡式為
,A發生加成反應生成B,A結構簡式為![]() ;結合E分子式知,D發生氧化反應生成E,E結構簡式為
;結合E分子式知,D發生氧化反應生成E,E結構簡式為 ,E發生加成反應結合F分子式知,F結構簡式為
,E發生加成反應結合F分子式知,F結構簡式為![]() ,F發生消去反應生成G:
,F發生消去反應生成G:![]() ,G與甲醇CH3OH發生酯化反應生成H,H結構簡式為
,G與甲醇CH3OH發生酯化反應生成H,H結構簡式為![]() ,據此分析解答。
,據此分析解答。
(1)通過以上分析知,A的結構簡式為![]() ;
;
(2)B是![]() ,B是鹵代烴,在NaOH水溶液中發生取代反應生成C
,B是鹵代烴,在NaOH水溶液中發生取代反應生成C![]() ,因此B→C所加試劑的名稱是NaOH水溶液;F是
,因此B→C所加試劑的名稱是NaOH水溶液;F是![]() ,與濃硫酸在加熱條件下發生消去反應生成G:
,與濃硫酸在加熱條件下發生消去反應生成G:![]() ,所以F→G的反應類型是消去反應;
,所以F→G的反應類型是消去反應;
(3)G是![]() ,與甲醇CH3OH在濃硫酸存在時,在加熱條件下發生酯化反應生成H:
,與甲醇CH3OH在濃硫酸存在時,在加熱條件下發生酯化反應生成H:![]() +CH3OH
+CH3OH ![]()
![]() +H2O;
+H2O;
(4)與肉桂酸互為同分異構體,且能使溴的四氯化碳溶液褪色,說明該物質內含有不飽和碳碳鍵,還能與碳酸氫鈉溶液反應,說明含有羧基,符合條件的同分異構體結構簡式為![]() 、
、 、
、 、
、 。
。


 黃岡冠軍課課練系列答案
黃岡冠軍課課練系列答案科目:高中化學 來源: 題型:
【題目】向含有1 mol KI的溶液中加入含0.1 mol X2O72的酸性溶液,使溶液中I-恰好全部被氧化生成I2,并使X2O72 被還原為Xn+,則n值為
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家很早就提出鋰-空氣電池的概念,它直接使用金屬鋰作電極,從空氣中獲得O2,和以LiFePO4作電極的鋰離子電池相比,增大了電池的能量密度(指標之一是單位質量電池所儲存的能量)。右圖是某種鋰-空氣電池的裝置示意圖,放電時,下列說法不正確的是

A. 金屬鋰為負極
B. 若隔膜被腐蝕,不會影響該電池正常使用
C. 多孔碳電極上發生的電極反應為:O2 + 2H2O + 4e- === 4OH-
D. 鋰-空氣電池能量密度大的原因之一是轉移等量電子時,金屬鋰比LiFePO4質量小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列兩種氣體的原子數一定相等的是
A. 質量相等、密度不等的N2和C2H4
B. 等體積、等密度的CO和N2
C. 等溫、等體積的O2和Cl2
D. 等壓、等體積的NH3和CO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某冶煉廠利用含ZnO的煙灰脫除工業廢氣中的SO2,最終得到鋅鹽。該廠所用煙灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
質量分數/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定條件下,將含SO2的工業廢氣通入煙灰漿液(煙灰和水的混合物)進行脫硫,過程中測得pH和上清液中溶解的SO2物質的量濃度[c(SO2)]隨時間的變化如圖所示:

(1)純ZnO漿液的pH為6.8,但上述煙灰漿液的初始pH為7.2。在開始脫硫后3 min內(a~b段),pH迅速降至6.8,引起pH迅速變化的原因是_____(結合化學用語解釋)。
(2)生產中脫除SO2效果最佳的時間范圍是_____(填字母序號)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脫硫過程中涉及到的主要反應原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min時,主要發生反應II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min時,pH降低的原因可能是______(寫出2點)。
③將脫硫后的混合物利用空氣氧化技術處理,該過程中發生反應:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中發生反應N2+3H22NH3 ,達到平衡后,只改變某一個條件時,反應速率與反應時間的關系如圖所示:回答下列問題:
(1)處于平衡狀態的時間段是________(填選項).
A.t0~t1 B.t1~t2 C.t2~t3 D.t3~t4 E.t4~t5 F.t5~t6
(2)t1、t3、t4時刻分別改變的一個條件是(填選項).
A.增大壓強 B.減小壓強 C.升高溫度 D.降低溫度 E.加催化劑 F.充入氮氣
t1時刻________;t3時刻________;t4時刻________.
(3)依據(2)中的結論,下列時間段中,氨的百分含量最高的是________(填選項).
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6時刻,從反應體系中分離出部分氨,此時正向速率________逆向速率(填大于、小于、等于),平衡________移動(填正向、逆向、不移動)。
(5)一定條件下,合成氨反應達到平衡時,測得混合氣體中氨氣的體積分數為20%,則反應后與反應前的混合氣體體積之比為________

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向H2C2O4溶液中滴加NaOH溶液,若pc=-lg c,則所得溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)與溶液pH的關系如圖所示。下列說法正確的是

A. M點時, 2c(HC2O4-)+c(C2O42-) >c(Na+)
B. pH=x時,c(HC2O4-)<c(H2C2O4)=c(C2O42-)
C. 常溫下,Ka2(H2C2O4)=10-1.3
D. ![]() 隨pH的升高而減小
隨pH的升高而減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將0.1mol/L的氫氧化鈉溶液與0.06mol/L硫酸溶液等體積混合,溶液的pH等于
A. 1.7 B. 2.0 C. 10 D. 12
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com