
【題目】(1)含11.2 g KOH的稀溶液與1 L0.1mol/L的H2SO4溶液反應放出11.46 kJ的熱量,該反應表示中和熱的熱化學方程式為___________________。
(2)將0.40 mol N2O4氣體充入2 L的恒容密閉容器中發生如下反應:N2O4(g) ![]() 2NO2(g)ΔH。在T1℃和T2℃時,測得NO2的物質的量隨時間變化如圖所示:
2NO2(g)ΔH。在T1℃和T2℃時,測得NO2的物質的量隨時間變化如圖所示:
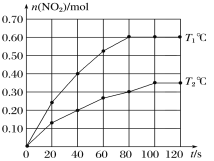
①T1℃,40~80 s內用N2O4表示該反應的平均反應速率為________mol/(L·s)。
②ΔH________0(填“>”、“<”或“=”)。
(3)向甲、乙兩個容積均為1 L的恒容容器中,分別充入2 mol A、2 mol B和1 mol A、1 mol B。相同條件下(溫度T ℃),發生下列反應:A(g)+B(g)![]() xC(g) ΔH<0。測得兩容器中c(A)隨時間t的變化如圖所示:
xC(g) ΔH<0。測得兩容器中c(A)隨時間t的變化如圖所示:
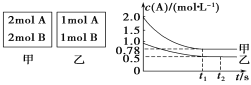
①甲容器平衡后物質B的轉化率為_______;
②T℃ 時該反應的平衡常數為________。
(4)在25 ℃下,將a mol/L的氨水與0.01mol/L的鹽酸等體積混合,反應平衡時溶液中c(NH4+)=c(Cl-)。
①則溶液顯________性(填“酸”“堿”或“中”);
②用含a的代數式表示NH3·H2O的電離常數Kb=__________________。
【答案】KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol 0.00125 > 61% 2 中
K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol 0.00125 > 61% 2 中 ![]()
【解析】
(1)先計算KOH、H2SO4的物質的量,然后判斷哪種物質過量,確定反應產生1mol液態水放出的熱量,即得該反應的中和熱的熱化學方程式;
(2)① Tl℃時,40s~80s內二氧化氮的物質的量從0.40mol變為0.60mol,根據v=![]() 計算出用二氧化氮表示的平均反應速率,然后根據反應速率與化學計量數成正比計算出用N2O4表示的平均反應速率;
計算出用二氧化氮表示的平均反應速率,然后根據反應速率與化學計量數成正比計算出用N2O4表示的平均反應速率;
②根據圖象曲線變化可知,Tl℃時反應速率大于T2℃,且T2℃達到平衡時二氧化氮的物質的量小于Tl℃,根據溫度對化學平衡的影響判斷該反應的反應熱;
(3)①先根據圖示計算出甲容器中A的轉化量,再結合方程式中A、B的轉換關系,計算出B的轉化量,最后根據轉化率等于轉化量與總量的比得到該物質的轉化率;
②計算甲、乙容器中A的轉化率,再根據壓強對A轉化率的影響來確定x值,進而利用三段式得到該反應平衡時的物質的量濃度,帶入平衡常數表達式,可計算出其平衡常數的值;
(4)氨水與鹽酸發生反應HCl+NH3H2O═NH4Cl+H2O,根據電荷守恒分析溶液的酸堿性,再根據平衡濃度計算氨水的電離常數。
(1)11.2g即0.2molKOH的稀溶液與1L、0.1mol/L的H2SO4溶液反應放出11.46kJ的熱量,其中堿含有的OH-的物質的量是0.2mol,酸溶液含有的H+的物質的量為0.1mol/L×1L×2=0.2mol,二者恰好反應生成0.2mol水,放出11.46kJ的熱量則反應產生1mol水放出熱量為11.46kJ÷0.2=57.3kJ,因此該反應的表示中和熱的熱化學方程式為:KOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol;
K2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol;
(2)①Tl℃時,40s~80s內二氧化氮的物質的量從0.40mol變為0.60mol,則用二氧化氮表示該時間段的平均反應速率為:v(NO2)=![]() =0.0025mol/(Ls),化學反應速率與化學計量數成正比,則v(N2O4)=
=0.0025mol/(Ls),化學反應速率與化學計量數成正比,則v(N2O4)=![]() v(NO2)=0.00125mol/(Ls);
v(NO2)=0.00125mol/(Ls);
②根據圖象曲線變化可知,Tl℃時反應速率大于T2℃,則溫度大小為:Tl℃>T2℃,而在T2℃達到平衡時二氧化氮的物質的量小于Tl℃,說明升高溫度,平衡向正反應方向移動,則該反應為吸熱反應,△H>0;
(3)①甲容器中A反應的物質的量為△n(A)=(2-0.78)mol/L×1L=1.22mol,根據A和B的關系式知,參加反應的B的物質的量也是1.22mol,則B的轉化率=![]() ×100%=61%;
×100%=61%;
②甲容器反應達到平衡后,c(A)0.78mol/L,A的轉化率=![]() ×100%=61%;乙容器中,A的轉化率=
×100%=61%;乙容器中,A的轉化率=![]() ×100%=50%,即壓強越大,A的轉化率越高,說明該反應的正反應是氣體體積減小的反應,因此x=1。反應方程式為:
×100%=50%,即壓強越大,A的轉化率越高,說明該反應的正反應是氣體體積減小的反應,因此x=1。反應方程式為:
A(g) + B(g) ![]() C(g)
C(g)
c(始)(mol/L) 2 2 0
c(變)(mol/L) 1.22 1.22 1.22
c(平)(mol/L) 0.78 0.78 1.22
所以該反應的平衡常數K=![]() =2;
=2;
(4)①氨水與鹽酸發生反應HCl+NH3H2O═NH4Cl+H2O,根據電荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),反應平衡時溶液c(NH4+)=c(Cl-),則溶液中c(H+)=c(OH-),所以溶液呈中性;
②平衡時由于c(NH4+)=c(Cl-),則c(NH4+)=![]() =0.005mol/L,根據物料守恒可得c(NH3H2O)=
=0.005mol/L,根據物料守恒可得c(NH3H2O)=![]() mol/L-0.005mol/L=(
mol/L-0.005mol/L=(![]() -0.005)mol/L,溶液為中性,則c(OH-)=10-7mol/L,所以NH3H2O的電離常數Kb=
-0.005)mol/L,溶液為中性,則c(OH-)=10-7mol/L,所以NH3H2O的電離常數Kb=![]() 。
。


科目:高中化學 來源: 題型:
【題目】用酸性氫氧燃料電池電解硫酸鈉飽和溶液的裝置如圖所示(a、b為銅電極)。下列說法中不正確的是( )
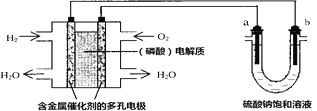
A. 電池工作時,正極反應式為:O2+4H++4e-=2H2O
B. 電解時,當陰極逸出a mol氣體,同時有W克Na2SO410H2O 析出,保持溫度不變,剩余溶中的硫酸鈉的質量分數是![]()
C. 電解時,電子流動路徑是:負極→外電路→陰極→陽極→正極
D. 若忽略能量損耗,當電池中消耗0.01mol O2 時,b 極周圍會產生0.02mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學類比鎂在二氧化碳中的燃燒反應:2Mg+CO2=2MgO+C,認為鈉和二氧化碳也可以發生反應,他在實驗室中選擇以下裝置對該反應能否發生進行了實驗探究。
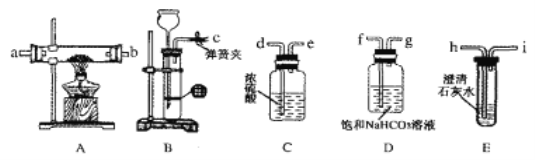
依據要求回答問題:
(1)二氧化碳的發生裝置應選用上述裝置中的__(填裝置下方對應字母),反應的離子方程式為___。
(2)為達到實臉目的,選擇上圖中的裝置,其連接順序為:二氧化碳的發生裝置→___。(按氣流方向,用小寫字母表示)。
(3)檢查裝置氣密性良好,裝好藥品后,打開彈簧夾,待裝置中的空氣排凈后才能點燃酒精燈。能說明裝置中空氣已經排凈的現象是___。
(4)若反應過程中CO2足量,反應結束后,該同學對硬質玻璃管中生成的固體提出了以下猜想:①生成的固體物質為Na2CO3,②生成的固體物質為Na2CO3和C的混合物,③生成的固體物質為Na2CO3和Na2O的混合物,④生成的固體物質為Na2O和C的混合物。報告給老師后,老師認為可以排除其中的3種情況,老師排除的理由是___;則鈉與CO2反應的化學方程式為___。
(5)該同學經過反思,認為上述實驗設計中存在缺陷。他查閱資料后得知,PdCl2溶液可以吸收CO,同時得到黑色的Pd。于是他在裝置后加裝一個盛PdCl2溶液的吸收裝置,該裝置中發生反應的化學方程式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某消毒液的主要成分為NaClO,還含有一定量的NaOH,下列用來解釋事實的方程式中不合理的是(已知:飽和NaClO溶液的pH約為11)
A. 該消毒液可用NaOH溶液吸收Cl2制備:Cl2+2OH-="==" Cl-+ ClO-+ H2O
B. 該消毒液的pH約為12:ClO-+ H2O![]() HClO+ OH-
HClO+ OH-
C. 該消毒液與潔廁靈(主要成分為HCl)混用,產生Cl2:2H++ Cl-+ ClO-= Cl2↑+H2O
D. 該消毒液加白醋生成HClO,可增強漂白作用:CH3COOH+ ClO-= HClO+CH3COO—
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合理利用資源,加強環境保護,降低碳排放,實施低碳經濟是今后經濟生活主流。回答下列問題:
(1)下列措施不利于有效減少二氧化碳的是______(填字母)。
a.植樹造林,保護森林,保護植被
b.加大對煤和石油的開采,并鼓勵使用液化石油氣
c.大力發展風能、水力、潮汐能發電和核電,大力推行太陽能的綜合開發
d.推廣使用節能燈和節能電器,使用空調時夏季溫度不宜設置過低,冬天不宜過高
(2)科學家致力于二氧化碳的“組合轉化”技術研究,如將CO2和H2以1∶4的物質的量之比混合通入反應器,在適當條件下反應可獲得一種重要能源。請完成以下化學方程式:CO2+4H2![]() _____+2H2O。
_____+2H2O。
(3)用CO2合成燃料甲醇(CH3OH)是碳減排的新方向。現進行如下實驗:某溫度下在體積為1L的密閉容器中,充入2molCO2和6molH2,發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。現測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。從反應開始到平衡,氫氣的平均反應速率v(H2)=___。
CH3OH(g)+H2O(g)。現測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。從反應開始到平衡,氫氣的平均反應速率v(H2)=___。
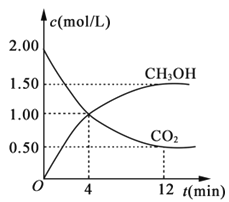
(4)以KOH為電解質的甲醇燃料電池總反應為2CH3OH+3O2+4KOH=2K2CO3+6H2O。通入甲醇的電極為燃料電池的______(填“正”或“負”)極,正極反應式為_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的數值,下列說法錯誤的是( )
A.常溫常壓下,1mol甲烷分子中所含質子數為10NA
B.2mol/L的NaCl溶液中鈉離數目為2NA
C.常溫下,46gNO2和N2O4的混合氣體中含有的氮原子數目為NA
D.若120g石墨能寫a個字,則平均每個字的含有10NA/a個碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】疊氮化鉀(![]() )能促使作物或難于萌發的種子發育。設計如下實驗制備疊氮化鉀并測定其純度:
)能促使作物或難于萌發的種子發育。設計如下實驗制備疊氮化鉀并測定其純度:
I.制備
步驟1:制備亞硝酸丁酯(![]() )
)
![]()
反應裝置如圖1(夾持裝置略去),向燒杯中依次加入稀硫酸、丁醇、亞硝酸鈉溶液,待反應完全后,分離出上層油狀物,用![]() 和
和![]() 的混合溶液洗滌三次,經干燥后備用。
的混合溶液洗滌三次,經干燥后備用。
步驟2:制備疊氮化鉀
![]()
反應裝置如圖2(夾持及加熱裝置路去),向儀器A中加入![]() 乙醇溶液、
乙醇溶液、![]() 的聯氨(
的聯氨(![]() )、亞硝酸丁酯,蒸汽浴加熱,反應完全后,疊氮化鉀即沉淀出來,冰浴冷卻,過濾,先用無水乙醇洗滌,再用無水乙醚洗滌,在空氣中于
)、亞硝酸丁酯,蒸汽浴加熱,反應完全后,疊氮化鉀即沉淀出來,冰浴冷卻,過濾,先用無水乙醇洗滌,再用無水乙醚洗滌,在空氣中于![]() 干燥。
干燥。


相關物質性質如下:
物質 | 顏色、狀態 | 沸點(℃) | 溶解性 |
| 無色晶體 | 受熱易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
| 無色液休 | 118 | 微溶于水,與乙醇、乙醚混溶 |
| 無色或淡黃色油狀液體 | 78 | 不溶于水,與乙醇、乙醚混溶 |
| 無色油狀液體 | 118 | 與水、乙醇混溶,不溶于乙醚 |
請回答:
(1)儀器A的名稱為_____________.
(2)步驟1中分離出亞硝酸丁酯的操作名稱為_____________;步驟1中用NaCl和NaHCO3的混合溶液洗滌的目的是__________________________.
(3)步驟2中冰浴冷卻的目的是__________________________;步驟2中干燥產品的溫度控制在55~60℃,原因是__________________________
(4)如需提高產品的純度,可在_____________(填編號)中進行重結晶。
A.無水乙醇 B.無水乙醚 C.水 D.乙醇的水溶液
Ⅱ.分光光度法測定產品的純度
原理:![]() 與
與![]() 反應非常靈敏,生成紅色絡合物,在一定波長下測量紅色溶液的吸光度,利用“
反應非常靈敏,生成紅色絡合物,在一定波長下測量紅色溶液的吸光度,利用“![]() 吸光度”曲線確定樣品溶液中的
吸光度”曲線確定樣品溶液中的![]() 。測定步驟如下:
。測定步驟如下:
①用![]() 品體配制
品體配制![]() 標準溶液;
標準溶液;
②配制一組相同體積(![]() )不同濃度的
)不同濃度的![]() 標準溶液,分別加入
標準溶液,分別加入![]() (足量)
(足量)![]() 標準溶液,搖勻,測量吸光度,繪制標準溶液的
標準溶液,搖勻,測量吸光度,繪制標準溶液的![]() 與吸光度的關系曲線,如圖;
與吸光度的關系曲線,如圖;
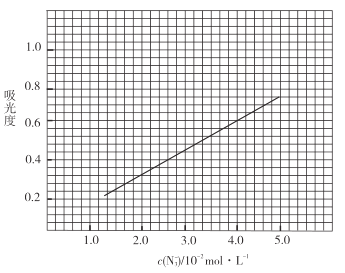
③產品測定:稱取0.360g產品,配成![]() 溶液,取出
溶液,取出![]() 于標準管中,加入
于標準管中,加入![]() (足量)
(足量)![]() 標準溶液,搖勻,測得吸光度為0.6。
標準溶液,搖勻,測得吸光度為0.6。
(5)實驗室用![]() 晶體配制
晶體配制![]() 標準溶液的方法為_________________.
標準溶液的方法為_________________.
(6)產品的純度為_________________;若③中加入的![]() 標準溶液不足以將產品完全反應,則測得的產品純度________________(填“偏高”“偏低”或“無影響”)。
標準溶液不足以將產品完全反應,則測得的產品純度________________(填“偏高”“偏低”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】芳香化合物A是一種基本化工原料,可以從煤和石油中得到。A、B、C、D、E的轉化關系如圖所示:回答下列問題:

⑴A的化學名稱是______;與A互為同分異構體的芳香化合物還有 _____種,其中核磁共振氫譜圖上顯示有5個峰,且峰面積之比為1:2:2:2:3的物質的結構簡式為:________________。
⑵A→B的反應類型是_______。
⑶A→E的化學方程式為____________________。
⑷A與酸性KMnO4溶液反應可得到D,寫出D的結構簡式:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無論以何種比例混合的10mL混和氣,在50mL的氧氣中燃燒生成CO2和液態的H2O,燃燒后所得氣體的體積為35mL,則該混合物可能為
A. C3H6 C4H6 B. C2H6 C3H6
C. C2H4 C3H8 D. C2H2 C2H6
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com