
【題目】二茂鐵[(C2H5)2Fe]的發現是有機金屬化合物研究中具有里程碑意義的事件,它開辟了有機金屬化合物研究的新領域。已知二茂鐵的熔點是173℃(在100℃以上能升華),沸點是249℃,不溶于水,易溶于苯、乙醚等有機溶劑。下列說法不正確的是( )
A.二茂鐵屬于分子晶體
B.在二茂鐵中,C5H5-與Fe2+之間形成的化學鍵類型是離子鍵
C.已知環戊二烯的結構式為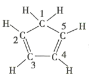 ,則其中僅有1個碳原子采取sp3雜化
,則其中僅有1個碳原子采取sp3雜化
D. C5H5-中一定含有![]() 鍵
鍵
科目:高中化學 來源: 題型:
【題目】據調查,劣質的家庭裝飾材料會釋放出近百種能引發疾病的有害物質,其中一種有機物分子的球棍模型如圖,圖中“棍”代表單鍵或雙鍵或三鍵,不同大小的球代表不同元素的原子,且三種元素位于不同的短周期。下面關于該有機物的敘述不正確的是

A.有機物化學式為C2HCl3B.可由乙炔和氯化氫加成得到
C.該有機物難溶于水![]() D.分子中所有原子在同一個平面內
D.分子中所有原子在同一個平面內
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,0.1mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三種形態含碳粒子,用NaOH或HCl調節該溶液的pH,三種含碳粒子的分布系數δ隨溶液pH變化的關系如圖[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液體積變化]。下列說法正確的是( )

A.pH=5時,溶液中主要含碳物種濃度大小關系為:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,則pKa2(H2C2O4)=4.17
C.0.1mol·L-1NaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定溫度下往CaC2O4飽和溶液中加入少量CaCl2固體,c(C2O42-)將減小,c(Ca2+)不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了減輕大氣污染,可在汽車尾氣排放處加裝“催化凈化器”裝置。
(1)通過“催化凈化器”的CO、NO在催化劑和高溫作用下可發生可逆反應,轉化為參與大氣循環的無毒混合氣體,寫出該反應的化學方程式:__。
(2)在一定溫度下,向1L密閉恒容容器中充入1molNO、2molCO,發生上述反應,10s時反應達到平衡,此時CO的物質的量為1.2mol。請回答下列問題:
①前10s內平均反應速率v(CO)=___。
②在該溫度下反應的平衡常數K=___。
③關于上述反應,下列敘述正確的是___(填字母)。
A.達到平衡時,移走部分CO2,平衡將向右移動,正反應速率加快
B.擴大容器的體積,平衡將向右移動
C.在相同的條件下,若使用甲催化劑能使正反應速率加快105倍,使用乙催化劑能使逆反應速率加快108倍,則應該選用乙催化劑
D.若保持平衡時的溫度不變,再向容器中充入0.8molCO和0.4molN2,則此時v正>v逆
④已知上述實驗中,c(CO)與反應時間t變化曲線Ⅰ如圖:

若其他條件不變,將1molNO、2molCO投入2L容器進行反應,請在圖中繪出c(CO)與反應時間t1變化曲線Ⅱ___(不要求標出CO的終點坐標)。
(3)測試某汽車冷啟動時的尾氣催化處理,CO、NO百分含量隨時間變化曲線如圖:

請回答:
前0~10s階段,CO、NO百分含量沒明顯變化的原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.聚丙烯能使酸性高錳酸鉀溶液褪色
B.聚乙烯是由分子組成的化合物,有固定的熔點
C.同質量的乙烯和聚乙烯燃燒后生成的![]() 的質量相等
的質量相等
D.高分子化合物的特點之一是組成元素簡單、結構復雜、相對分子質量大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
鉀和碘的相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)元素K的焰色反應呈紫紅色,其中紫色對應的輻射波長為_______nm(填標號)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基態K原子中,核外電子占據的最高能層的符號是_________,占據該能層電子的電子云輪廓圖形狀為___________。K和Cr屬于同一周期,且核外最外層電子構型相同,但金屬K的熔點、沸點等都比金屬Cr低,原因是___________________________。
(3)X射線衍射測定等發現,I3AsF6中存在I3+離子。I3+離子的幾何構型為_____________,中心原子的雜化形式為________________。
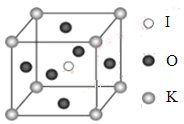
(4)KIO3晶體是一種性能良好的非線性光學材料,具有鈣鈦礦型的立體結構,邊長為a=0.446nm,晶胞中K、I、O分別處于頂角、體心、面心位置,如圖所示。K與O間的最短距離為______nm,與K緊鄰的O個數為__________。
(5)在KIO3晶胞結構的另一種表示中,I處于各頂角位置,則K處于______位置,O處于______位置。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。回答下列問題:
(1)寫出基態As原子的核外電子排布式___________。
(2)AsCl3分子的立體構型為_________,其中As的雜化軌道類型為________。
(3)GaF3的熔點高于1000℃,GaCl2的熔點為77.9℃,其原因是______________。
(4)GaAs的熔點為1238℃,密度為ρ g/cm3,其晶胞結構如圖所示。該晶體的類型為______________,Ga與As以______________鍵結合。Ga和As的摩爾質量分別為MGa g/mol和MAs g/mol,原子半徑分別為rGa pm和rAs pm,阿伏加德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為______________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鎘(Ni﹣Cd)可充電電池在現代生活中有廣泛應用。電解質溶液為KOH溶液,電池反應為:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有關鎳鎘電池的說法正確的是( )
Cd(OH)2+2Ni(OH)2,下列有關鎳鎘電池的說法正確的是( )
A.充電過程是化學能轉化為電能的過程
B.充電時陽極反應為Cd(OH)2+2e-=Cd+2OH-
C.放電時電池內部OH-向負極移動
D.充電時與直流電源負極相連的電極上發生Ni(OH)2轉化為NiO(OH)的反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下將NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH與離子濃度變化的關系如圖所示。下列敘述錯誤的是

A. Ka2(H2X)的數量級為10-6
B. 曲線N表示pH與 的變化關系
的變化關系
C. NaHX溶液中c(H+)>c(OH-)
D. 當混合溶液呈中性時,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com