
【題目】實驗室用稀硝酸與銅反應制備NO氣體,如果采用圖Ⅰ裝置(燒瓶內加入稀硝酸和銅片,必要時可加熱),實驗效果不是十分理想,因為觀察到的現象不能有力證明反應產物是NO。有人設計了圖Ⅱ裝置(橡皮塞下端連有銅絲圈),用來做該實驗可以達到滿意的效果。
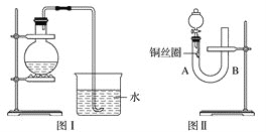
(1)用圖Ⅰ裝置做實驗時,用排水法收集到的氣體的顏色為_____色;實驗過程中由于______,不易觀察到____________生成,從而不能有力證明反應產物是NO。
(2)用圖Ⅱ裝置做實驗時,將有關操作補充完全:
①將分液漏斗的活塞打開,從U形管的B側管口注入稀硝酸,一直注到____________為止。
②關閉活塞,用酒精燈在U形管的A側加熱,當______時,立即撤去酒精燈。
(3)根據圖Ⅱ裝置的實驗完成下列問題:
①反應在什么情況下可以自動停止?________________________。
可在何處觀察到無色的NO氣體?____________________________________________。
②如果將分液漏斗的活塞慢慢打開,可立即觀察到哪些明顯現象?_________________。
【答案】無 燒瓶中有空氣,可以將產生的NO氧化成NO2 無色的NO 液面與橡皮塞接觸(或A側管中恰好充滿液體) 銅絲上有氣泡產生 當反應產生的NO氣體,使銅絲圈與稀硝酸脫離時,反應立即停止 在U形管A側管內可觀察到無色NO氣體 U形管B側管內的稀硝酸又回到A側管中,分液漏斗中有紅棕色氣體產生
【解析】
銅與稀硝酸反應:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,為放熱反應,NO易被空氣中的O2氧化為NO2(紅棕色),本題實驗Ⅱ中的意圖是創設無氧氣環境,使NO能存在相當長一段時間,結合NO2的性質解答該題。
(1)NO2可與水反應生成NO,為無色氣體,燒瓶內有空氣,與生成的NO很快被氧化為紅棕色的NO2,不易觀察到有無色的NO生成,答案:無;燒瓶中有空氣,可以將產生的NO氧化成NO2;無色的NO。
(2)①實驗時應將裝置內的空氣完全排除,則應單孔塞下沿與液面間不留有空隙,否則不能觀察到無色氣體,
故答案為:液面與橡皮塞接觸(或A側管中恰好充滿液體)。
②銅絲與稀硝酸的反應為放熱反應,當生成氣體時可停止解熱,反應放出的熱量可維持反應繼續進行,
故答案為:銅絲上有氣泡產生。
(3)①當銅絲和稀硝酸不接觸時,反應會自動停止,在左側可觀察到無色氣體,
故答案為:當反應產生的NO氣體,使銅絲圈與稀硝酸脫離時,反應立即停止;在U型管A側管內可觀察到無色的NO氣體。
②如果再將分液漏斗的活塞慢慢打開,右側壓強大于左側,U形管B側管內的稀硝酸又回到A側管中,NO與空氣接觸而生成紅棕色氣體,
故答案為:U形管B側管內的稀硝酸又回到A側管中,分液漏斗中有紅棕色氣體產生。


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:
【題目】常溫下,下列粒子濃度關系錯誤的是
A. 0.1 mol·L-1CH3COONa溶液中:c(Na+)>c(OH-)>c(CH3COOH)>c(H+)
B. pH=5的CH3COOH和CH3COONa混合溶液中:c(CH3COO-)>c(Na+)
C. 將0.2mol·L-1CH3COOH溶液與0.1mo1·L-1NaOH溶液等體積混合:c(CH3COO一)+c(CH3COOH) = 2c(Na+)
D. 向0.10mol·L-1NH4HCO3溶液中通入CO2至中性:c(NH4+) = c(HCO3-)+ c(CO32-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制乙烯并驗證其性質,請回答下列問題:
(1)寫出以乙醇為原料制取乙烯的化學方程式:________________________________________。
(2)某同學欲使用如圖1所示裝置制取乙烯,請你改正其中的錯誤:________________________。
實驗過程中發現燒瓶中出現黑色固體,這會導致生成的乙烯中現有雜質氣體,請寫出生成雜質氣體的化學方程式:__________________________________________________。
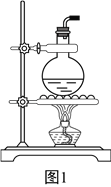
(3)要驗證乙烯的化學性質(裝置如圖2所示,尾氣處理裝置已略去),請將虛線框中的裝置補充完整并標出所有試劑。______________
(4)有些同學提出以溴乙烷為原料制取乙烯,該反應的化學方程式為:____________________。若以溴乙烷為原料,圖2中虛線框內的裝置(填“能”或“不能”)__________省略,請說明理由:____________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.光導纖維的主要成分是SiO2
B.工業濃硝酸通常呈黃色
C.實驗室可以用NaOH溶液處理SO2和NO2
D.Cl2具有很強的氧化性,在化學反應中只能做氧化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨基甲酸銨(H2NCOONH4)是一種易分解、易水解的白色固體,某研究小組以氫氧化鈉固體、濃氨水、干冰等為原料制備氨基甲酸銨的實驗裝置如圖所示,其主要反應的原理為2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<O。
NH2COONH4(s) △H<O。
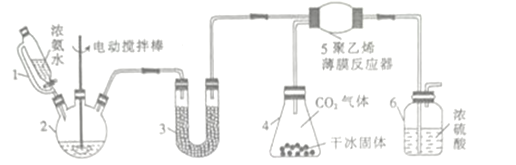
(1)儀器2的名稱是________,儀器3中盛裝的固體是_________,其作用是______________。
(2)儀器6的一個作用是控制原料氣按反應計量系數充分反應,若反應初期觀察到裝置內濃硫酸中產生氣泡,則應該______________(填“加快”“ 減慢”或“不改變”)產生氨氣的速率。
(3)另一種制備氨基甲酸氨的反應裝置(液體石蠟和CCl4均充當惰性介質)如圖所示。
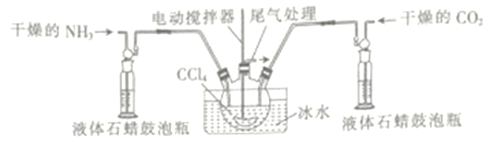
①液體石蠟鼓泡瓶的作用是_____________________ 。
②若無冰水,則氨基甲酸鐵易分解生成尿素[CO(NH)2]2請寫出氨基甲酸銨受熱分解的化學方程式:_______________________。
③當CCl4液體中產生較多晶體懸浮物時,立即停止反應,過濾分離得到粗產品,為了將所得粗產品干燥,可采取的方法是_______________(填字母)。
A.蒸餾 B.真空微熱烘干 C.高壓加熱烘干
(4)制得的氨基甲酸銨中可能含有碳酸氫銨、碳酸銨中的一種或兩種雜質(不考慮氨基甲酸銨與水的反應)。
①設計方案進行成分探究,請填寫表中空格。
限選試劑:蒸餾水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀鹽酸。
實驗步驟 | 預期現象和結論 |
步驟1:取少量固體樣品于試管中,加入蒸餾水至固體溶解 | 得到無色溶液 |
步驟2:向試管中加入過量的BaCl2溶液,靜置 | 若溶液不變渾濁,則證明固體中不含碳酸銨 |
步驟3:向試管中繼續加入___________ | _____________________________, 則證明固體中含有碳酸氫銨 |
②根據①的結論,取15.8g氨基甲酸氨樣品,用足量氫氧化鋇溶液充分處理后,過濾洗滌、干燥測得沉淀質量為1.97g。則樣品中氨基甲酸銨的質量分數為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質分離的方法正確的是( )
A.從碘水中提取碘:用酒精萃取
B.除去CO中少量O2:通過灼熱的Cu網后收集氣體
C.除去KCl溶液中的少量MgCl2:加入適量NaOH溶液,過濾
D.除去CO2中的少量HCl:通入飽和NaHCO3溶液,收集氣體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com