
【題目】以環戊烷為原料制備環戊二烯的合成路線如圖,則下列說法正確的是( )
![]()
A. A的結構簡式是![]()
B. ①②的反應類型分別是取代、消去
C. 反應②③的條件分別是濃硫酸加熱、光照
D. 加入酸性KMnO4溶液,若溶液褪色則可證明![]() 已完全轉化為
已完全轉化為![]()
【答案】B
【解析】
根據環戊烷為原料制備環戊二烯的合成路線:根據逆向思維的方法推導,C為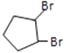 ,B為
,B為![]() ,A為
,A為![]() ,據此分析解答。
,據此分析解答。
A.由上述分析可知,A為![]() ,故A錯誤;
,故A錯誤;
B.根據合成路線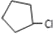 ,反應①為光照條件下的取代反應,反應②為在氫氧化鈉醇溶液中加熱發生消去反應,反應③為加成反應,反應④為在氫氧化鈉醇溶液中加熱發生消去反應,故B正確;
,反應①為光照條件下的取代反應,反應②為在氫氧化鈉醇溶液中加熱發生消去反應,反應③為加成反應,反應④為在氫氧化鈉醇溶液中加熱發生消去反應,故B正確;
C.反應②為鹵代烴的消去反應,需要的反應試劑和反應條件為氫氧化鈉醇溶液、加熱,反應③為烯烴的加成反應,條件為常溫,故C錯誤;
D.B為環戊烯,含碳碳雙鍵,環戊二烯含碳碳雙鍵,均能使高錳酸鉀褪色,則酸性KMnO4溶液褪色不能證明環戊烷已完全轉化成環戊二烯,故D錯誤;
答案選B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】在一密閉容器中,放入鎳粉并充入一定量的CO氣體,一定條件下發生可逆反應:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知該反應在25℃、80℃時的平衡常數分別為5×104和2,下列說法正確的是( )
Ni(CO)4(g),已知該反應在25℃、80℃時的平衡常數分別為5×104和2,下列說法正確的是( )
A.上述生成Ni(CO)4(g)的反應為吸熱反應
B.80℃時,測得某時刻Ni(CO)4(g)、CO(g)濃度均為0.5 mol·L-1,則此時v(正)<v(逆)
C.恒溫恒壓下,向容器中再充入少量的Ar,上述平衡將正向移動
D.恒溫恒容下,向容器中再充入少量的Ni(CO)4(g),達到新平衡時CO的百分含量將增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列對化學平衡移動的分析中,不正確的是
①已達平衡的反應C(s)+H2O(g)![]() CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
CO(g)+H2(g),當增加反應物物質的量時,平衡一定向正反應方向移動
②已達平衡的反應N2(g)+3H2(g)![]() 2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高
2NH3(g),當增大N2的濃度時,平衡向正反應方向移動,N2的轉化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密閉容器中,發生反應:PCl3(g)+ Cl2(g)![]() PCl5(g)達平衡時,PCl5為0.4mol,如果此時移走1.0 molPCl3 和0.50 molCl2,在相同溫度下再達平衡時PCl5的物質的量應大于0.20mol而小于0.40mol
PCl5(g)達平衡時,PCl5為0.4mol,如果此時移走1.0 molPCl3 和0.50 molCl2,在相同溫度下再達平衡時PCl5的物質的量應大于0.20mol而小于0.40mol
④有氣體參加的反應達平衡時,在恒壓反應器中充入稀有氣體,平衡不會發生移動
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車安全氣囊彈出時的反應為:![]() 下列說法正確的是( )
下列說法正確的是( )
A.自然界中氮、鈉、硅元素均可以游離態形式存在
B.將反應后的固體溶于適量水,靜置,通入![]() ,無現象
,無現象
C.微粒的半徑:![]()
D.若反應中轉移![]() 電子,則消耗
電子,則消耗![]() 的質量為
的質量為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廣東省有著豐富的海洋資源。海水提取食鹽和Br2以后的鹽鹵可以用來制備純凈的MgCl2或MgO。鹽鹵中含有Mg2+、Cl-,還含有少量Na+、Fe2+、Fe3+和CO(NH2)2等.制備流程如圖所示:
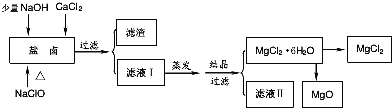
(1)濾渣的成分是____________(填化學式);濾液Ⅱ中所含的主要雜質離子是________(寫離子符號)。
(2)用NaClO除去尿素CO(NH2)2時,生成物除鹽外,都是能參與大氣循環的物質,則該反應的化學方程式為_____________________;
(3)用MgCl26H2O制備無水MgCl2過程中,所需要的化學試劑是___________________;
(4)海水制溴過程中吸收潮濕空氣中的Br2是利用SO2氣體,SO2吸收Br2的離子方程式是_______________;SO2氣體可來源于硫酸工業的尾氣,同時,SO2尾氣也可用氨水吸收,作為制備化肥的原料,SO2氣體用氨水吸收得到的產物可能是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應CO(g)+2H2(g)![]() 2CH3OH(g)在恒容密閉容器中進行。為探究溫度、CO2等因素對該反應的影響,進行了4組實驗,結果如右下表。下列說法不正確的是
2CH3OH(g)在恒容密閉容器中進行。為探究溫度、CO2等因素對該反應的影響,進行了4組實驗,結果如右下表。下列說法不正確的是
組序號 | 1 | 2 | 3 | 4 | |
反應溫度/℃ | 225 | 235 | 225 | 235 | |
反應前氣體的物質的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
CO | 3.0 | 3.0 | 2.8 | 2.8 | |
H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
平衡時CH3OH的體積分數/% | 4.9 | 8.8 | 36.5 | 50.7 | |
A.該反應的△H>0
B.當容器中壓強不變時,反應達到平衡
C.CH3OH含量增大的原因是CO2
D.少量CO2能提高平衡時CH3OH的體積分數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用CO生產燃料甲醇。一定條件下發生反應:CO(g)+2H2(g)![]() CH3OH(g)。圖1表示反應中能量的變化;圖2表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
CH3OH(g)。圖1表示反應中能量的變化;圖2表示一定溫度下,在體積為2L的密閉容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
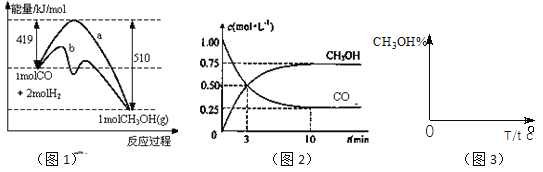
請回答下列問題:
(1)在“圖1”中,曲線___(填:a或b)表示使用了催化劑;該反應屬于_____(填:吸熱、放熱)反應。
(2)下列說法正確的是_____
A.起始充入的CO為2mol
B.增加CO濃度,CO的轉化率增大
C.容器中壓強恒定時,反應已達平衡狀態
D.保持溫度和密閉容器容積不變,再充入1molCO和2molH2,再次達到平衡時
n(CH3OH)/n(CO)會減小
(3)從反應開始到建成平衡, v(H2)=________;已知:在一定溫度下,當一個可逆反應達到化學平衡時,生成物濃度冪之積與反應物濃度冪之積的比值是一個常數,這個常數就是該反應的化學平衡常數,那么在該溫度下CO(g)+2H2(g)![]() CH3OH(g)的化學平衡常數為_______________。若保持其它條件不變,將反應體系升溫,則該反應化學平衡常數____(填“增大”、“減小”或“不變”)。
CH3OH(g)的化學平衡常數為_______________。若保持其它條件不變,將反應體系升溫,則該反應化學平衡常數____(填“增大”、“減小”或“不變”)。
(4)請在“圖3”中畫出平衡時甲醇百分含量(縱坐標)隨溫度(橫坐標)變化的曲線,要求畫壓強不同的2條曲線________(在曲線上標出P1、P2,且P1<P2)。
(5) 有一類甲醇質子交換膜燃料電池,需將甲醇蒸氣轉化為氫氣,兩種反應原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,請寫出32g的CH3OH(g)完全燃燒生成液態水的熱化學方程式____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 是引起“溫室效應”的主要物質,節能減排,高效利用化石能源,控制
是引起“溫室效應”的主要物質,節能減排,高效利用化石能源,控制![]() 排放,探索
排放,探索![]() 的循環利用是保護環境,促進經濟科持續發展的重要舉措.
的循環利用是保護環境,促進經濟科持續發展的重要舉措.
(1)在一定溫度下,向2L固定容積的密閉容器中通入2mol![]() ,3mol
,3mol![]() ,發生反應為:
,發生反應為:![]() ,測得
,測得![]() 和
和![]() 的濃度隨時間變化如圖1所示.
的濃度隨時間變化如圖1所示.
①能說明該反應已達到平衡狀態的是 ______
A.![]() 體積分數在混合氣體中保持不變
體積分數在混合氣體中保持不變
B.單位時間內有![]()
![]() 斷裂,同時有
斷裂,同時有![]()
![]() 鍵生成
鍵生成
C.混合氣體的密度不隨時間變化
D.當體系中![]() :
:![]() :l,且保持不變
:l,且保持不變
②下列措施能使![]() 增大的是 ______
增大的是 ______
A.升高溫度 ![]() 恒溫恒容充入
恒溫恒容充入![]()
![]() 使
使![]() 變成
變成![]()
D.恒溫恒容下,再充入2mol![]() ,3mol
,3mol![]()
③計算該溫度下此反應的平衡常數![]() ______ ;若使
______ ;若使![]() 應采取的措施是 ______
應采取的措施是 ______
A.增大壓強![]() 恒壓加入一定量
恒壓加入一定量![]() C.恒容通入
C.恒容通入![]() D.降低溫度
D.降低溫度![]() 升高溫度
升高溫度
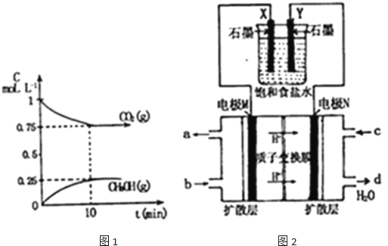
(2)如圖2所示:用某甲醇燃料電池作電源電解飽和食鹽水.
①寫出電極N發生的反應式: ______
②若食鹽水體積為300Ml,電解過程溶液體積變化忽略不計,常溫下測得![]() 時,理論上消耗甲醇質量為 ______
時,理論上消耗甲醇質量為 ______ ![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com