
【題目】已知碳碳單鍵可以繞鍵軸自由旋轉,結構簡式為如下圖所示的烴,下列說法中正確的是( )

A. 分子中處于同一直線上的碳原子最多有6個
B. 分子中至少有12個碳原子處于同一平面上
C. 該烴苯環上的一氯代物共有 3種
D. 該烴苯環上一氯代物共有5種
科目:高中化學 來源: 題型:
【題目】工業上利用軟錳礦漿煙氣脫硫吸收液制取電解錳,并利用陽極液制備高純碳酸錳、回收硫酸銨的工藝流程如下(軟錳礦的主要成分是MnO2,還含有硅、鐵、鋁的氧化物和少量重金屬化合物等雜質):
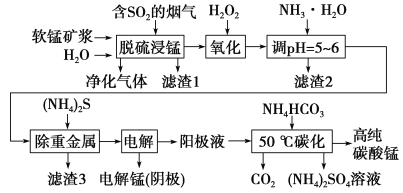
(1)一定溫度下,“脫硫浸錳”主要產物為MnSO4,該反應的化學方程式為_______________________。
(2)“濾渣2”中主要成分的化學式為______________。
(3)“除重金屬”時使用(NH4)2S而不使用Na2S的原因是______________________。
(4)“電解”時用惰性電極,陽極的電極反應式為_______________________________。
(5)“50 ℃碳化”得到高純碳酸錳,反應的離子方程式為____________________________。“50 ℃碳化”時加入過量NH4HCO3,可能的原因:使MnSO4充分轉化為MnCO3;________________;________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應aA (g) +bB (s) ![]() cC (g) +dD (g),其他條件不變,C的物質的量分數中(C)和溫度(T)或壓強(P)關系如圖,其中正確的是
cC (g) +dD (g),其他條件不變,C的物質的量分數中(C)和溫度(T)或壓強(P)關系如圖,其中正確的是
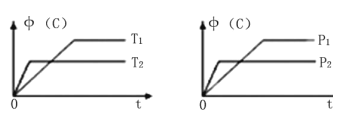
A. 降低溫度,平衡正向移動 B. 使用催化劑,中(C)增加
C. 化學方程式系數a+b<c+d D. 其它條件不變,加入B,平衡正向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含有KI、NaBr的混合溶液中通入過量的Cl2充分反應。將溶液蒸干并灼燒,最后剩余的固體物質是( )
A.KI和NaBr B.KCl和NaCl C.KCl和NaBr D.KCl、NaCl和I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應的離子方程式書寫正確的是( )
A.鋅粒與稀鹽酸反應:Zn+2H+=Zn2++H2↑
B.溴化鈉溶液與氯氣反應:Br﹣+Cl2=Cl﹣+Br2
C.氫氧化銅與稀硫酸反應:OH﹣+H+=H2O
D.鈉與水反應:Na++2H2O=Na++2OH﹣+H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水是一個巨大的化學資源庫,下列有關海水綜合利用的說法正確的是( )
A.利用潮汐發電是將化學能轉化為電能
B.海水蒸發制海鹽的過程中只發生了化學變化
C.從海水中可以得到NaCl,電解熔融NaCl可制備Na
D.海水中含有溴元素,只需經過物理變化就可以得到溴單質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞氯酸鈉(NaClO2)是一種重要的含氯消毒劑,主要用于水的消毒以及砂糖的漂白和殺菌,其一種生產工藝流程如下:

回答下列問題:
(1) 寫出“反應”步驟中生成ClO2的化學方程式:________________________。
(2) “電解”所用食鹽水由粗鹽水精制而成,精制時為除去Mg2+和Ca2+,要加入的試劑分別為___________________、___________________。

(3) 亞氯酸鈉(NaClO2)在水溶液中可生成ClO2、HClO2、ClO![]() 、Cl-等,其中HClO2和ClO2都具有漂白作用。經測定,25℃時各組分含量隨pH變化情況如圖所示(Cl-沒有畫出)。則使用該漂白劑的適宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。經測定,25℃時各組分含量隨pH變化情況如圖所示(Cl-沒有畫出)。則使用該漂白劑的適宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 為了測定NaClO2·3H2O的純度,取上述合成產品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于錐形瓶中,再加入足量硫酸酸化的KI溶液,充分反應后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3標準溶液滴定,共用去Na2S2O3標準溶液20.00 mL,通過計算確定該產品純度是否合格?(合格純度在90%以上)(寫出計算過程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列根據實驗操作和現象所得出的結論正確的是
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 將SO2氣體通入Ba(NO3)2溶液 | 有白色沉淀 | SO2中混有SO3 |
B | 向NaAlO2溶液中持續通入氣體Y | 先出現白色沉淀,最終沉淀又溶解 | Y可能是CO2氣體 |
C | AgCl懸濁液中滴入少量Na2S溶液 | 沉淀變黑色 | Ksp(Ag2S)>Ksp(AgCl) |
D | 向盛有KI3溶液的兩試管中分別加入淀粉溶液和AgNO3溶液 | 前者溶液變藍色,后者有黃色沉淀 | KI3溶液中存在平衡: I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用軟錳礦漿煙氣脫硫吸收液制取電解錳,并利用陽極液制備高純碳酸錳、回收硫酸銨的工藝流程如下(軟錳礦的主要成分是MnO2,還含有硅、鐵、鋁的氧化物和少量重金屬化合物等雜質):

(1)一定溫度下,“脫硫浸錳”主要產物為MnSO4,該反應的化學方程式為______________________。
(2)“濾渣2”中主要成分的化學式為______________________。
(3)“除重金屬”時使用(NH4)2S而不使用Na2S的原因是_______________________________________。
(4)“電解”時用惰性電極,陽極的電極反應式為____________________________。
(5)“50℃碳化”得到高純碳酸錳,反應的離子方程式為_______________________________________。“50℃碳化”時加入過量NH4HCO3,可能的原因是______________________________________(寫兩種)。
(6)已知:25℃時,KW=1.0×10-14,Kb(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:
NH4++H2O![]() NH3·H2O+H+,則該反應的平衡常數為____________________。
NH3·H2O+H+,則該反應的平衡常數為____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com