
【題目】乙烯是重要的化工原料,以乙烯為原料生產部分化工產品的流程如下(部分反應條件已略去):
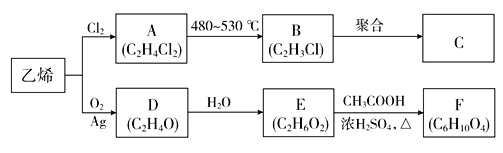
已知:E分子中含有兩個羥基,且不連在同一個碳原子上。
請回答下列問題:
(1)由乙烯生成A的反應類型為________。
(2)C是一種常見的塑料,其化學名稱為_________。
(3)D是環狀化合物,其結構簡式為__________________。
(4)寫出下列反應的化學方程式:
①A→B:_____________________
②E→F:_____________________
(5)已知烯烴能發生如下反應:
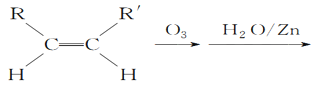 RCHO+R′CHO
RCHO+R′CHO
請寫出下列反應產物的結構簡式
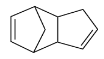
![]()
![]() ____________。
____________。
【答案】加成反應 聚氯乙烯 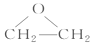 Cl—CH2—CH2—Cl
Cl—CH2—CH2—Cl![]() Cl—CH=CH2+HCl HOCH2CH2OH+2CH3COOH
Cl—CH=CH2+HCl HOCH2CH2OH+2CH3COOH![]() CH3COOCH2CH2OOCCH3+2H2O
CH3COOCH2CH2OOCCH3+2H2O 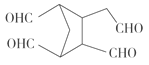
【解析】
乙烯與氯氣發生加成反應生成1,2-二氯乙烷,A是Cl—CH2—CH2—Cl;A在一定條件下發生消去反應生成氯乙烯,B是Cl—CH=CH2;氯乙烯發生加聚反應生成聚氯乙烯,C是![]() ;D是分子式為C2H4O的環狀化合物,D是
;D是分子式為C2H4O的環狀化合物,D是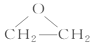 ;E分子中含有兩個羥基,且不連在同一個碳原子上,E是HOCH2CH2OH;HOCH2CH2OH與乙酸發生酯化反應生成F,F是CH3COOCH2CH2OOCCH3。
;E分子中含有兩個羥基,且不連在同一個碳原子上,E是HOCH2CH2OH;HOCH2CH2OH與乙酸發生酯化反應生成F,F是CH3COOCH2CH2OOCCH3。
根據以上分析,(1)乙烯生成與氯氣反應生成Cl—CH2—CH2—Cl,反應類型為加成反應。
(2)氯乙烯發生加聚反應生成![]() ,
,![]() 的化學名稱為聚氯乙烯。
的化學名稱為聚氯乙烯。
(3)D是分子式為C2H4O的環狀化合物,D是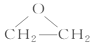 。
。
(4)①Cl—CH2—CH2—Cl在一定條件下發生消去反應生成Cl—CH=CH2,反應方程式是Cl—CH2—CH2—Cl![]() Cl—CH=CH2+HCl;
Cl—CH=CH2+HCl;
②HOCH2CH2OH與乙酸發生酯化反應生成CH3COOCH2CH2OOCCH3的方程式是HOCH2CH2OH+2CH3COOH![]() CH3COOCH2CH2OOCCH3+2H2O;
CH3COOCH2CH2OOCCH3+2H2O;
(5)根據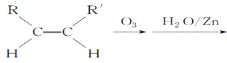 RCHO+R′CHO可知,雙鍵碳原子被氧化為醛基, 所以
RCHO+R′CHO可知,雙鍵碳原子被氧化為醛基, 所以![]()
![]()
![]()
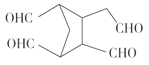 。
。


 浙江新課程三維目標測評課時特訓系列答案
浙江新課程三維目標測評課時特訓系列答案 周周清檢測系列答案
周周清檢測系列答案 輕巧奪冠周測月考直通高考系列答案
輕巧奪冠周測月考直通高考系列答案科目:高中化學 來源: 題型:
【題目】室溫下,依次進行如下實驗:
①取一定量冰醋酸,配制成100mL0.1mol/L醋酸溶液;
②取20mL①中所配溶液,加入20mL0.1mol/LNaOH溶液;
③繼續滴加amL0.1mol/L稀鹽酸,至溶液的pH=7。
下列說法正確的是
A.①中溶液的pH=1
B.②中反應后溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.③中,a=20
D.③中,反應后溶液:c(Na+)=c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】[Zn(CN)4]2-在水溶液中可與HCHO發生反應生成[Zn(H2O)4]2+和HOCH2CN,下列說法錯誤的是( )
A.Zn2+基態核外電子排布式為[Ar]3d10
B.1molHCHO分子中含有σ鍵的數目為3mol
C.HOCH2CN分子中碳原子軌道的雜化類型是sp3
D.[Zn(CN)4]2-中Zn2+與CN-的C原子形成配位鍵,結構可表示為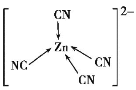
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學原理在防止金屬腐蝕、能量轉換、物質合成等方面應用廣泛。
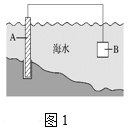
(1)圖1中,為了減緩海水對鋼閘門A的腐蝕,材料B可以選擇______(填字母)。
a.碳棒 b.鋅板 c.銅板
(2)鎂燃料電池在可移動電子設備電源和備用電源等方面應用前景廣闊。圖2為“鎂—次氯酸鹽”燃料電池原理示意圖,電極為鎂合金和鉑合金。
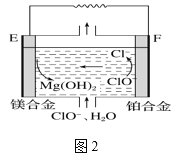
①E為該燃料電池的______(填“正”或“負”)極。F電極上的電極反應式為_________。
②鎂燃料電池負極容易發生自腐蝕產生氫氣,使負極利用率降低,用化學方程式解釋其原因______________________。
(3)乙醛酸(HOOC—CHO)是有機合成的重要中間體。工業上用“雙極室成對電解法”生產乙醛酸,原理如圖3所示,該裝置中陰、陽兩極為惰性電極,兩極室均可產生乙醛酸,其中乙二醛與M電極的產物反應生成乙醛酸。
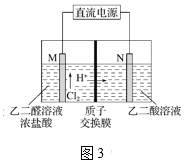
①N電極上的電極反應式為_____________。
②若有2 molH+通過質子交換膜,并完全參與了反應,則該裝置中生成的乙醛酸為__mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】過氧化鈣是一種溫和的氧化劑,常溫下為白色的固體,易溶于酸,難溶于水、乙醇等溶劑。某實驗小組擬選用如圖裝置(部分固定裝置略)制備過氧化鈣。
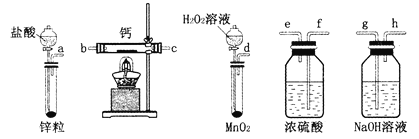
(1)請選擇必要的裝置,按氣流方向連接順序為____________(填儀器接口的字母編號,裝置可重復使用)。
(2)根據完整的實驗裝置進行實驗,實驗步驟如下:
①檢驗裝置的氣密性后,裝入藥品;
②打開分液漏斗活塞,通入一段時間氣體,加熱藥品;
③反應結束后,________(填操作);
④拆除裝置,取出產物。
(3)一小組同學利用CaCl2在堿性條件下與H2O2反應制得。制備CaO2的實驗方案和裝置示意圖:

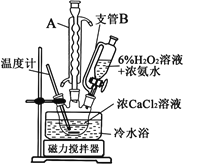
①三頸燒瓶中發生的主要反應的化學方程式為___________________________________;
②支管B的作用是_________________________;
③步驟③中洗滌CaO2·8H2O的液體X的最佳選擇是____________;
A.無水乙醇B.濃鹽酸C.水D.CaCl2溶液
④該反應常用冰水浴控制溫度在℃左右,其可能的原因該反應是放熱反應,溫度低有利于提高CaO2·8H2O產率;________________________________________。
(4)測定產品中CaO2含量的實驗步驟:
步驟一:準確稱取ag產品于有塞錐形瓶中,加入適量蒸餾水和過量的bgKI晶體,再滴入少量2mol·L-1的硫酸,充分反應。
步驟二:向上述錐形瓶中加入幾滴________(作指示劑)。
步驟三:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,滴定至終點,記錄數據,再重復上述操作2次,得出三次平均消耗Na2S2O3溶液的體積為VmL。
CaO2的質量分數為________(用字母表示)。(已知:I2+2S2O32-===2I-+S4O62-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯乙烯(![]() )是生產各種塑料的重要單體,可通過乙苯催化脫氫制得:
)是生產各種塑料的重要單體,可通過乙苯催化脫氫制得:
![]() (g)
(g)![]()
![]() (g)+H2(g)△H
(g)+H2(g)△H
(1)已知:
化學鍵 | C-H | C-C | C=C | H-H |
鍵能/kJ/mol | 412 | 348 | 612 | 436 |
計算上述反應的△H=________kJ·mol-1。
(2)500℃時,在恒容密閉容器中,充入amol乙苯,反應達到平衡后容器內氣體的壓強為P;若再充入bmol的乙苯,重新達到平衡后容器內氣體的壓強為2P,則a_______b(填“>”“<”或“=”),乙苯的轉化率將________(填“增大”“減小”或“不變”)。
(3)工業上,通常在乙苯(EB)蒸氣中摻混N2(原料氣中乙苯和N2的物質的量之比為1︰10,N2不參與反應),控制反應溫度600℃,并保持體系總壓為0.1Mpa不變的條件下進行反應。在不同反應溫度下,乙苯的平衡轉化率和某催化劑作用下苯乙烯的選擇性(指除了H2以外的產物中苯乙烯的物質的量分數)示意圖
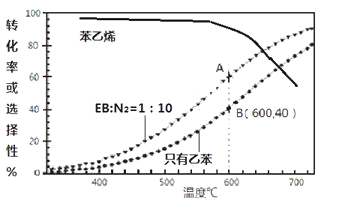
①A、B兩點對應的正反應速率較大的是________。
②摻入N2能提高乙苯的平衡轉化率,解釋說明該事實____________。
③控制反應溫度為600℃的理由是__________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物分子M只含有C、H、O三種元素,其球棍模型如圖所示。下列有關M的說法正確的是( )
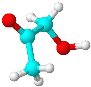
A.M中只含有一種官能團
B.M與濃硫酸共熱能發生消去反應
C.M能與H2在一定條件下發生加成反應
D.M和乙酸互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】借助于李比希法、現代科學儀器及化學實驗可以測定有機物的組成和結構。實驗興趣小組用如下圖所示的裝置測定某有機物X(含元素C、H、O中的兩種或三種)的組成。實驗測得樣品X消耗的質量為1.50g,高氯酸鎂質量增加0.90g,堿石棉質量增加2.20g。
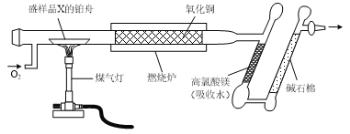
(1)由實驗數據分析計算可得X的實驗式為_____。
(2)若紅外光譜測得X中含有“C=O”和“C-O-C”的結構,質譜法測得X的相對分子質量是60,則X的名稱為_______。
(3)若實驗測得相同狀況下,X蒸汽的密度是H2密度的45倍(已知相同狀況下,氣體的密度比等于摩爾質量之比),X能發生銀鏡反應,1mol X最多能與2mol Na發生反應。則X的結構簡式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(10分)含碳物質的價值型轉化,有利于“減碳”和可持續性發展,有著重要的研究價值。請回答下列問題:
(1)已知CO分子中化學鍵為C≡O。相關的化學鍵鍵能數據如下:
化學鍵 | H—O | C≡O | C=O | H—H |
E/(kJ·mol1) | 463 | 1075 | 803 | 436 |
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡轉化率的措施有_______________(填標號)。
CO2(g)+H2(g) ΔH=___________kJ·mol1。下列有利于提高CO平衡轉化率的措施有_______________(填標號)。
a.增大壓強 b.降低溫度
c.提高原料氣中H2O的比例 d.使用高效催化劑
(2)用惰性電極電解KHCO3溶液,可將空氣中的CO2轉化為甲酸根(HCOO),然后進一步可以制得重要有機化工原料甲酸。CO2發生反應的電極反應式為________________,若電解過程中轉移1 mol電子,陽極生成氣體的體積(標準狀況)為_________L。
(3)乙苯催化脫氫制取苯乙烯的反應為:![]() (g)+CO2(g)
(g)+CO2(g)![]()
![]() (g)+CO(g)+H2O(g),其反應歷程如下:
(g)+CO(g)+H2O(g),其反應歷程如下:
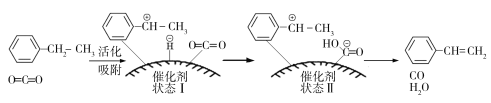
①由原料到狀態Ⅰ____________能量(填“放出”或“吸收”)。
②一定溫度下,向恒容密閉容器中充入2 mol乙苯和2 mol CO2,起始壓強為p0,平衡時容器內氣體總物質的量為5 mol,乙苯的轉化率為_______,用平衡分壓代替平衡濃度表示的化學平衡常數Kp=_______。[氣體分壓(p分)=氣體總壓(p總)×氣體體積分數]
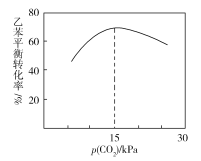
③乙苯平衡轉化率與p(CO2)的關系如下圖所示,請解釋乙苯平衡轉化率隨著p(CO2)變化而變化的原因________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com