
【題目】下列關于葡萄糖與蔗糖的說法錯誤的是( )。
A.二者的分子式不同,但所含化學元素相同
B.蔗糖能水解,葡萄糖不能水解
C.二者互為同分異構體
D.葡萄糖是單糖,能發生銀鏡反應,蔗糖是雙糖,不能發生銀鏡反應
科目:高中化學 來源: 題型:
【題目】下列分子結構圖中的大黑點表示原子序數小于10的元素的“原子實”(指原子除去最外層電子的剩余部分),小黑點表示沒形成共價鍵的最外層電子,短線表示共價鍵。其中分子結構圖與化學式關系錯誤的是
A. ![]() (C3H4O)B.
(C3H4O)B. ![]() (HCN)
(HCN)
C. ![]() (NH3)D.
(NH3)D. ![]() (BF3)
(BF3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高爐煉鐵中發生的基本反應之一如下:FeO(s) +CO(g)![]() Fe(s)+CO2(g)(正反應是吸熱反應),已知1100℃時K=0.263。
Fe(s)+CO2(g)(正反應是吸熱反應),已知1100℃時K=0.263。
(1)溫度升高,化學平衡移動后達到新的平衡,高爐內CO2和CO的體積比值________;平衡常數K值___________ (選填“增大”“減小”或“不變”)。
(2)1100℃時測得高爐中c(CO2)=0.025mol·L﹣1、c(CO)=0.1mol·L﹣1,在這種情況下,該反應是否處于化學平衡狀態_________ (選填“是”或“否”),此時,化學反應速率是v(正)_____ v(逆)(選填“大于”“小于”或“等于”),其原因是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組設計的用化學電源使LED燈發光的裝置如圖。下列說法錯誤的是( )

A. 銅片表面有氣泡生成,鋅片上發生氧化反應
B. 如果將稀硫酸換成葡萄糖溶液,不能使LED燈發光
C. 裝置中存在“化學能→電能→光能”的轉換
D. 如果將銅片換成鐵片,則鋅片為正極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】富馬酸(反式丁烯二酸)與Fe2+形成的配合物——富馬酸鐵又稱“富血鐵”,可用于治療缺鐵性貧血。以下是合成富馬酸鐵的一種工藝路線:

回答下列問題:
(1)A的化學名稱為_____由A生成B的反應類型為_____。
(2)C的結構簡式為_____。
(3)富馬酸的結構簡式為_____。
(4)檢驗富血鐵中是否含有Fe3+的實驗操作步驟是_____。
(5)富馬酸為二元羧酸,1mol富馬酸與足量飽和NaHCO3溶液反應可放出____L CO2(標況);富馬酸的同分異構體中,同為二元羧酸的還有____________(寫出結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用化學原理可以對工廠排放的廢水、廢渣等進行有效檢測與合理處理。某工廠對制革工業污泥中Cr(Ⅲ)的處理工藝流程如下:
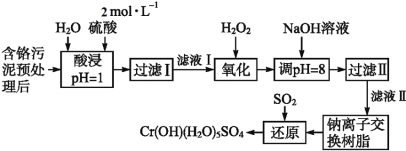
已知:①硫酸浸取液中的金屬離子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常溫下,部分陽離子以氫氧化物形式沉淀時溶液的pH如下:
陽離子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全時的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)實驗室用18.4 mol·L-1的濃硫酸配制480 mL 2 mol·L-1的硫酸,需量取濃硫酸_________mL;配制時所用玻璃儀器除量筒、膠頭滴管、燒杯和玻璃棒外,還需__________________________。
(2)H2O2的作用是將濾液Ⅰ中的Cr3+轉化為Cr2O72-,寫出此反應的離子方程式:__________。
(3)加入NaOH溶液使溶液呈堿性,既可以除去某些雜質離子,同時又可以將Cr2O72-轉化為CrO42-,寫出該反應的離子方程式__________________。
(4)鈉離子交換樹脂的反應原理為:Mn+ + n NaR = MRn + n Na+,則利用鈉離子交換樹脂可除去濾液Ⅱ中的金屬陽離子有__________________。
(5)寫出上述流程中用SO2進行還原時發生反應的離子方程式:_________________。
(6)沉淀滴定法是測定粒子濃度的方法之一,為了測定某廢水中SCN-濃度,可用標準AgNO3溶液滴定待測液,已知:
銀鹽性質 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
顏色 | 白 | 黃 | 白 | 磚紅 | 白 |
Ksp | 1.8×10-10 | 8.3×10-17 | 1.2×10-16 | 3.5×10-11 | 1.0×10-12 |
滴定時可選為滴定指示劑的是_________(選填編號),滴定終點現象是:________。
A.NaCl B.K2CrO4 C.KI D.NaCN
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】液體燃料電池相比于氣體燃料電池具有體積小,無需氣體存儲裝置等優點。一種以肼(N2H4)為燃料的電池裝置如圖所示。該電池用空氣中的氧氣作為氧化劑,KOH作為電解質。下列關于該燃料電池的敘述不正確的是

A. 電流從右側電極經過負載后流向左側電極
B. 負極發生的電極反應式為N2H4+4OH--4e-===N2+4H2O
C. 該燃料電池的電極材料應采用多孔導電材料,以提高電極反應物質在電極表面的吸附量,并使它們與電解質溶液充分接觸
D. 該燃料電池持續放電時,正極發生氧化反應,pH減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖所示裝置可制備LiOH,兩電極區電解液分別為LiCl溶液和LiOH溶液。下列說法錯誤的是

A. B極區的電極反應式2H2O+2e-=H2↑+2OH-
B. A極的電勢一定比B極的高
C. 實際電解過程中A極區pH減小
D. 若改為陰離子交換膜,則兩極氣體產物仍相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2SO3是一種重要的還原劑,I2O5是一種重要的氧化劑,二者都是化學實驗室中的重要試劑。
(1)已知:2Na2SO3 (aq)+O2(aq)==2Na2SO4(aq) △H =m kJ·mol-1,O2(g)![]() O2(aq) △H =n kJ·mol-1 ,則Na2SO3溶液與O2(g)反應的熱化學方程式為______________________________。
O2(aq) △H =n kJ·mol-1 ,則Na2SO3溶液與O2(g)反應的熱化學方程式為______________________________。
(2)Na2SO3的氧化分富氧區和貧氧區兩個階段,貧氧區速率方程為v=k·ca(SO32-)·cb(O2),k為常數。
①當溶解氧濃度為4.0 mg/L(此時Na2SO3的氧化位于貧氧區)時,c(SO32-)與速率數值關系如下表所示,則a=____。
c(SO32-)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
V×106 | 10.2 | 24.4 | 44.7 | 103.6 |
②兩個階段的速率方程和不同溫度的速率常數之比如下表所示。已知1n(k2/k1)=Ea/R(1/T2-1/T1),R 為常數,則Ea(富氧區)______(填“>”或“<”)Ea(貧氧區)。
反應階段 | 速率方程 | k(297.0K)/k(291.5K) |
富氧區 | v= k·c(SO32-)·c(O2) | 1.47 |
貧氧區 | v= k·ca(SO32-)·cb(O2) | 2.59 |
(3)等物質的量的Na2SO3和Na2SO4混合溶液中,c(SO32-) +c( HSO3-)______(填“>”“<”或“=”)c(SO42-)。
(4)利用I2O5可消除CO 污染,其反應為I2O5(s)+5CO(g) ![]() 5CO2(g)+I2(s),不同溫度下,向裝有足量I2O5固體的2 L 恒容密閉容器中通入2 mol CO,測得CO2氣體的體積分數φ(CO2) 隨時間t的變化曲線如圖所示。
5CO2(g)+I2(s),不同溫度下,向裝有足量I2O5固體的2 L 恒容密閉容器中通入2 mol CO,測得CO2氣體的體積分數φ(CO2) 隨時間t的變化曲線如圖所示。

①從反應開始至a點時的平均反應速率v(CO)=__________。
②b點時,CO 的轉化率為_____________。
③b點 和 d點 的 化學 平衡常數:Kb____(填“ >”“<”或“=” )Kd,判斷的理由是_____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com