D
分析:根據元素的定義及原子和離子的核內質子數與核外電子數的關系分析. 當核電荷數=質子數=核外電子數,為原子;當核電荷數=質子數>核外電子數,為陽離子;當核電荷數=質子數<核外電子數,為陰離子;相對穩定結構是指最外層電子數為8,只有一個電子層時為2的結構.
解答:A、第二種粒子中質子數12大于核外電子數10,是陽離子,第四種粒子中質子數11大于核外電子數10,屬于陽離子,故A錯誤;
B、第一種和第四種粒子中質子數等于核外電子數,是原子,B錯誤;
C、元素是具有相同核電荷數的一類原子的總稱,四種微粒質子數不同,所以屬于不同種元素,它們表示四種元素,故C錯誤;
D、第一種粒子只有一個電子層且有兩個電子,已達到相對穩定結構,其它三種粒子最外層電子數為8,達到8電子的相對穩定結構,故D正確;
故選D
點評:本題考查學生對粒子結構示意圖及其意義的理解,明確粒子中核內質子數和核外電子數之間的關系、核外電子在化學變化中的作用和得失電子的規律特點等是解題的關鍵.

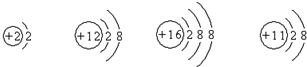


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案 目標測試系列答案
目標測試系列答案