現有4.5g不純的鐵粉跟75g16%的硫酸銅溶液,恰好完全反應(雜質不參加反應且能溶)求:
(1)鐵粉中雜質的質量分數?______
(2)反應后溶液的溶質質量分數?______.
【答案】
分析:鐵與硫酸銅反應生成銅和硫酸亞鐵,根據反應化學方程式中物質間的質量關系,由恰好完全反應時消耗硫酸銅的質量,可計算不純鐵粉中所含鐵的質量及反應生成硫酸亞鐵和銅的質量,再利用質量守恒定律求得反應后所得溶液的質量,即可完成計算.
解答:解:設鐵粉中所含量鐵的質量為x,反應生成硫酸亞鐵的質量為y,生成銅的質量為z
Fe+CuSO
4═Cu+FeSO
456 160 64 152
x 75g×16% z y
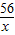
=
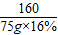
=
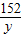
=
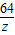
x=4.2g,y=11.4g,z=4.8g
(1)鐵粉中雜質的質量分數=
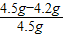
×100%=6.7%
(2)反應后溶液的溶質質量分數=
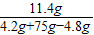
×100%=15.3%
故答案為:
(1)6.7%;
(2)15.3%.
點評:根據化學方程式可以表示反應中各物質的質量比,由反應中一種物質的質量可計算反應中其它物質的質量.

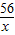 =
=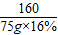 =
=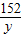 =
=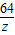
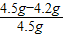 ×100%=6.7%
×100%=6.7%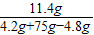 ×100%=15.3%
×100%=15.3%

 小學課時特訓系列答案
小學課時特訓系列答案