
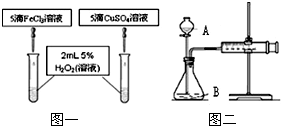
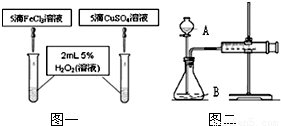
 在我校實驗室實施的揚州市2011年中考化學實驗操作考查剛剛落下帷幕.實驗考查中H2O2分解制氧氣為何不采用MnO2作催化劑?同學們為之展開了探究.
在我校實驗室實施的揚州市2011年中考化學實驗操作考查剛剛落下帷幕.實驗考查中H2O2分解制氧氣為何不采用MnO2作催化劑?同學們為之展開了探究.| 催化劑及用量 | O2 平均產量 | 制氧所需時間 | 成本 | 反應情況 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均勻產生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均勻產生O2 |

| 濃度 時間(min) 條件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
 2H2O+O2↑
2H2O+O2↑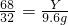 解得:Y=20.4g
解得:Y=20.4g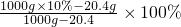 =8.65%
=8.65%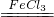 2H2O+O2↑;
2H2O+O2↑;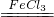 2H2O+O2↑;(3)反應產生氣泡快慢,使酸根相同,排除酸根的影響因素,將FeCl3改為Fe2(SO4)3;(4)關閉,良好,A;[交流討論]H2O2溶液的質量分數越大產生氧氣的速率越快.
2H2O+O2↑;(3)反應產生氣泡快慢,使酸根相同,排除酸根的影響因素,將FeCl3改為Fe2(SO4)3;(4)關閉,良好,A;[交流討論]H2O2溶液的質量分數越大產生氧氣的速率越快.

科目:初中化學 來源: 題型:閱讀理解
 在我校實驗室實施的揚州市2011年中考化學實驗操作考查剛剛落下帷幕.實驗考查中H2O2分解制氧氣為何不采用MnO2作催化劑?同學們為之展開了探究.
在我校實驗室實施的揚州市2011年中考化學實驗操作考查剛剛落下帷幕.實驗考查中H2O2分解制氧氣為何不采用MnO2作催化劑?同學們為之展開了探究.| 催化劑及用量 | O2 平均產量 | 制氧所需時間 | 成本 | 反應情況 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均勻產生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均勻產生O2 |
| ||
| ||
| 濃度 時間(min) 條件 |
30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |
查看答案和解析>>
科目:初中化學 來源:2011年江蘇省揚州中學教育集團樹人學校中考化學模擬試卷(6月份)(解析版) 題型:填空題
| 催化劑及用量 | O2 平均產量 | 制氧所需時間 | 成本 | 反應情況 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均勻產生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均勻產生O2 |
| 濃度 時間(min) 條件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |

查看答案和解析>>
科目:初中化學 來源:2011年江蘇省揚州市江都市國際學校中考適應性考試化學試卷(解析版) 題型:填空題
| 催化劑及用量 | O2 平均產量 | 制氧所需時間 | 成本 | 反應情況 |
| MnO21.0g | 919mL | 10′03″ | 0.11元 | 分解先快后慢 |
| 10%FeCl3溶液5滴 | 985mL | 4′50″ | 0.02元 | 均勻產生O2 |
| 15%CuSO4溶液5滴 | 955mL | 4′57″ | 0.03元 | 均勻產生O2 |

| 濃度 時間(min) 條件 | 30% H2O2 | 15% H2O2 | 5% H2O2 |
| 加入a g MnO2 | 0.2 | 0.8 | 2.0 |

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com