
 實驗室保存著一瓶濃鹽酸,瓶的標簽的部分內容如右圖所示,請你根據標簽上提供的數據回答下列問題.
實驗室保存著一瓶濃鹽酸,瓶的標簽的部分內容如右圖所示,請你根據標簽上提供的數據回答下列問題. ,
, ,
,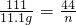 ,
,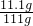 ×100%=10%,
×100%=10%,

 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
 實驗室保存的一瓶濃鹽酸,瓶上的標簽部分內容如圖所示,請你根據標簽上的提供的數據回答下列問題:
實驗室保存的一瓶濃鹽酸,瓶上的標簽部分內容如圖所示,請你根據標簽上的提供的數據回答下列問題:查看答案和解析>>
科目:初中化學 來源: 題型:
 (2010?大慶)實驗室保存著一瓶濃鹽酸,瓶的標簽的部分內容如右圖所示,請你根據標簽上提供的數據回答下列問題.
(2010?大慶)實驗室保存著一瓶濃鹽酸,瓶的標簽的部分內容如右圖所示,請你根據標簽上提供的數據回答下列問題.查看答案和解析>>
科目:初中化學 來源: 題型:
 實驗室保存的一瓶濃鹽酸,瓶上標簽的部分內容如圖所示,請你根據標簽上提供的數據解答下列問題(計算結果精確到0.01)
實驗室保存的一瓶濃鹽酸,瓶上標簽的部分內容如圖所示,請你根據標簽上提供的數據解答下列問題(計算結果精確到0.01)查看答案和解析>>
科目:初中化學 來源: 題型: